近年來,間充質干細胞被廣泛應用于癌癥等疾病的治療和研究,并被證明在對抗癌癥方面具有巨大潛力。本文概述了間充質干細胞對抗癌癥的三種主要途徑:間充質干細胞外泌體對抗癌癥、間充質干細胞作為癌癥靶向藥物載體、間充質干細胞抑制癌癥藥物副作用,幫助大家了解間充質干細胞與癌癥的“博弈”過程。

基于不斷的實驗和嘗試,人們一致認為間充質干細胞是對抗癌癥的有力武器。據綜述表明,間充質干細胞在癌癥治療領域發揮著重要作用,廣泛應用于癌癥相關研究和治療。基于間充質干細胞的先進細胞治療已被證明對癌癥患者是安全的,但其臨床療效目前有限。未來,可以利用基因工程、膜修飾等方法增強間充質干細胞遷移和腫瘤殺傷活性,使其成為更強大的“癌癥智能武器”。
研究發現,間充質干細胞可以通過多種手段達到對抗癌癥的目的,包括對抗癌癥的間充質干細胞外泌體、作為癌癥靶向藥物載體的間充質干細胞、抑制癌癥藥物副作用的間充質干細胞。接下來,我們來詳細總結一下這三條路徑。
路徑一:間充質干細胞外泌體抑制腫瘤
近年來,間充質干細胞外泌體在癌癥等疾病的治療研究中得到了廣泛應用。外泌體是一種小顆粒的細胞外小囊泡,像“貨船”一樣,含有蛋白質、核酸、脂質等其他“貨物”,在各種疾病中發揮著重要作用。它的成分也受到環境和藥物的影響,并且在不同的疾病中有所不同。
來源于間充質干細胞的外泌體含有豐富的蛋白質、mRNA 和 miRNA,可以有效抑制腫瘤。它們的蛋白質組學,包括膜蛋白和可溶性蛋白,在細胞間通信、組織再生和臨床應用中發揮著重要作用。
題為“Mesenchymal stem cell-derived exosomes as a new therapeutic strategy in the brain tumors”的新綜述,重點介紹了間充質干細胞衍生來源的外泌體的特性及其在腦部惡性腫瘤治療中的應用前景。
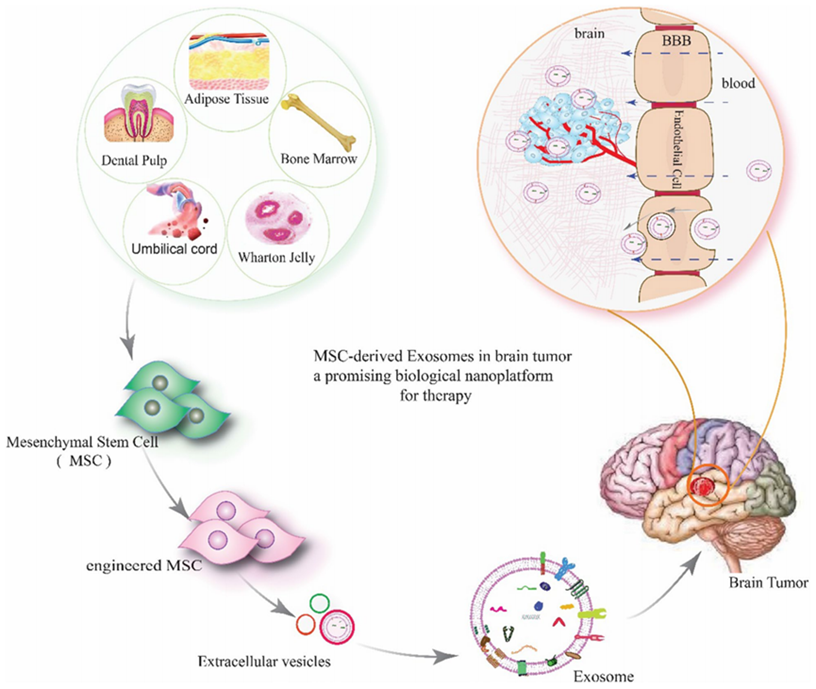
由于血腦屏障(BBB)的存在,許多藥物無法進入大腦病變并發揮其作用,使其成為治療藥物無法到達的“禁區”。間充質干細胞外泌體由于其獨特的特性,擁有著“禁區”的兩大“通行證”。首先,是被內皮細胞這個“禁區守門人員”吸收并轉運到病灶細胞,其次,是通過內皮細胞之間(可以理解為兩守門人員之間的無人看管的區域)的連接直接進入 CNS 發揮作用。
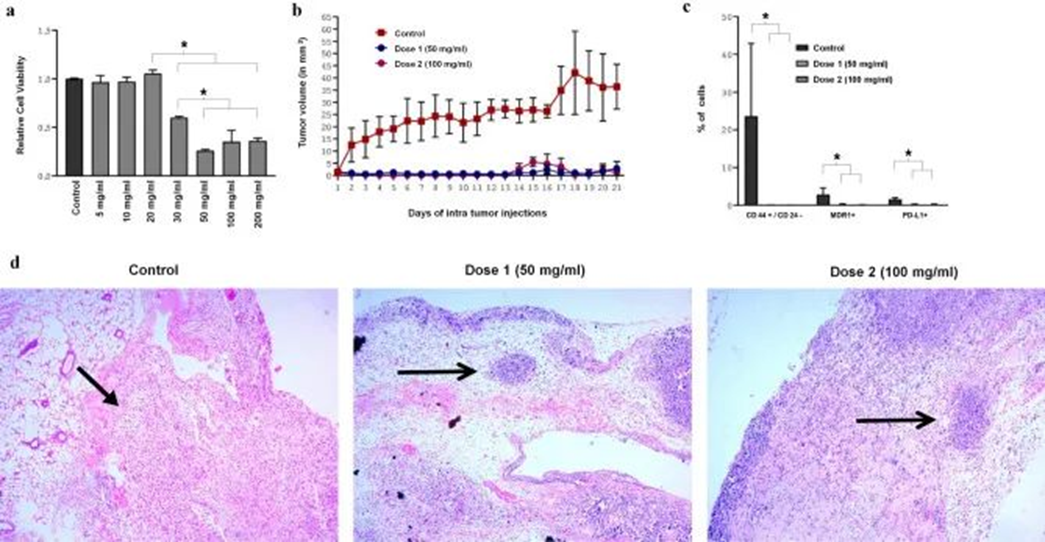
發表在《scientific reports》的一篇文章顯示了脂肪來源的間充質干細胞外泌體抑制耐藥三陰性乳腺癌(TBNC)生長的潛在治療效果。研究人員首先獲得了干細胞外泌體,體外實驗證實,當外泌體濃度超過 20 mg/ml 時,耐藥的三陰性乳腺癌癥細胞將被顯著殺死。然后構建 TNBC 小鼠模型,驗證干細胞外分泌對耐藥三陰性乳腺癌癥的抑制作用。
路徑二:間充質干細胞作為抗癌藥物的“精準”運送工具
近年來,間充質干細胞作為腫瘤靶向藥物的載體已成為一個熱門領域。這些干細胞就像快遞卡車,能夠將藥物輸送到特定位置,并將有效藥物直接輸送到腫瘤部位。
間充質干細胞(MSC)具有廣泛的獲取途徑、強大的再生能力、抗炎能力、免疫抑制、腫瘤歸巢和固有的抗癌能力,是抗癌病毒的合適載體。
伊朗德黑蘭 AJA 醫科大學的一個研究團隊在 cell communication and signaling 雜志上發表了一篇綜述,回顧和總結了間充質干細胞為載體的溶瘤病毒的特征及其對抗腫瘤的活性,并探討了其抗癌效果和挑戰。

溶瘤病毒(OV)是一種天然存在或基因操縱的病毒,只在腫瘤細胞中復制和生長,殺死腫瘤細胞而不損害正常細胞。作為一種新型的癌癥治療方法,溶瘤病毒治療具有殺傷效率高、靶向性強、無交叉耐藥性、安全性高等優點。這些優點使其成為未來最有前途和前景的癌癥治療方法之一。
(1)間充質干細胞+溶瘤病毒,強強聯合對抗癌癥
MSC 作為 OV 的載體,不僅可以抑制病毒治療過程中的局部炎癥,而且可以讓溶瘤病毒在不受免疫限制的情況下復制和破壞癌癥細胞的基本特征,達到強力聯合殺傷腫瘤的目的。
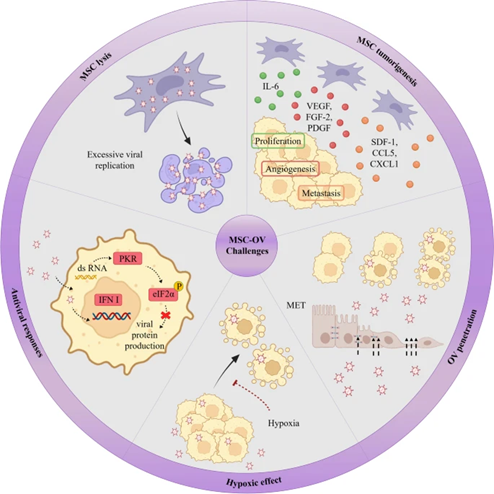
注:基于間充質干細胞的溶瘤病毒遞送挑戰
(2)研究證實:MSC-OV 可治療多種癌癥
基于 MSC 的溶瘤腺病毒(oAds)遞送:由于 oAds 的復制可能僅限于惡性細胞,這些病毒療法正在治療各種惡性腫瘤的臨床試驗中進行評估。目前的研究發現,間充質干細胞最終通過 oAd 復制和裂解,從而避免了與體內干細胞活力相關的任何負面副作用。體內研究表明,受感染的 MSCs 可以有效且特異性地將 ICOVIR15 和 Ad.iC9 的組合轉運到肺部腫瘤部位,從而特異性地提高總生存率和腫瘤控制。此外,另一項研究表明,癌癥靶向 oAd 可以成功地修飾成 MSC。負載 oAd 的 MSCs 不僅可以通過病毒增殖抑制癌癥細胞增殖和降低肝臟毒性,而且具有很高的安全性。
基于 MSC 的溶瘤性單純皰疹病毒(oHSV)遞送:oHSV 和間充質干細胞的組合已被廣泛評估,并在治療神經膠質瘤、轉移性黑色素瘤、乳腺癌和卵巢癌方面顯示出強大的潛力。在腦腫瘤小鼠模型中,Du 等人使用 MSCs 作為 oHSV 的細胞載體,發現 MSC-oHSV 可以有效檢測腦轉移沉積,抑制腦腫瘤的發展,延長生存期。
基于 MSC 的溶瘤性麻疹病毒(oMV)遞送:oMV 存在于各種人類腫瘤異種移植物中,具有顯著的抗癌潛力。它作為一種創新的腫瘤治療方法正在多項 I 期臨床研究中進行研究。目前,實驗表明 oMV 對癌癥、癌癥、白血病和骨髓瘤小鼠有很強的治療作用。在患有淋巴細胞白血病的癌癥和癌癥小鼠模型中,單次靜脈注射攜帶 MV 的 MSC 不會通過預先存在的抗病毒抗體中和病毒,并具有良好的治療效果。
基于 MSC 的溶瘤性粘液瘤病毒(MYXY)遞送:BM-MSC 也已被證明是治療小鼠惡性腫瘤的 MYXV 載體。在肺黑色素瘤小鼠和原位胰腺導管腺癌(PDAC)小鼠中,輸注載有 MYXV(MYXY)的 MSC 提高了癌癥小鼠的存活率,腫瘤逐漸消退,免疫相關細胞增加,表明了 MYXY 的抗癌潛力。
基于 MSC的 溶瘤呼腸孤病毒遞送:包括急性髓系白血病在內的各種人類惡性腫瘤都可以用含有呼腸孤毒的 MSC 進行治療。目前,有相關產品可供選擇:Reolysin? 是一種針對胰腺、卵巢和惡性神經膠質瘤的新型全身性抗癌藥物,于 2015 年獲得 FDA 批準。載有 reoT3D 的 MSC 在患有癌癥的小鼠中具有很強的根除癌癥細胞的能力。
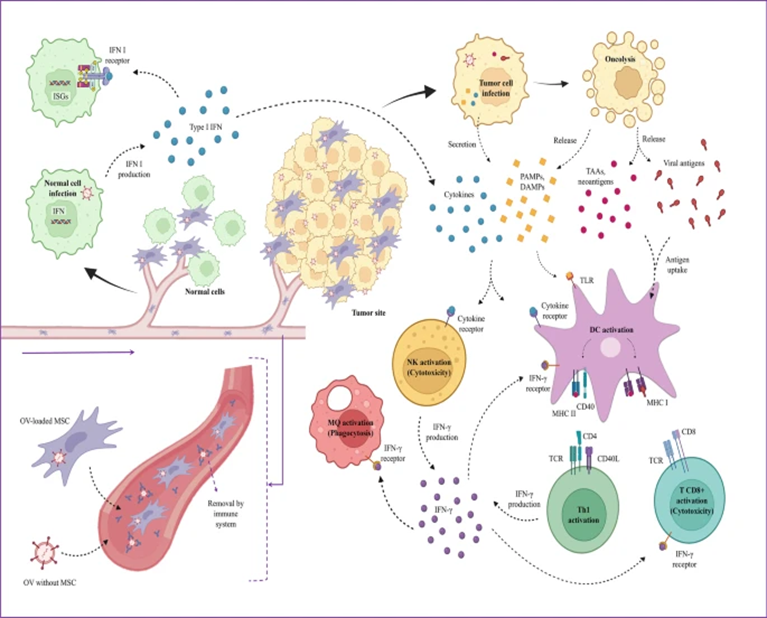
注:MSC-OV 作用機制
(3)臨床試驗:越來越多癌癥使用 MSC-OV 治療
目前,只有少數臨床試驗使用 MSC-OV 治療癌癥患者。第一項試驗使用 CELYVIR(X 射線照射的攜帶 ICOVIR-5 的自體 MSCs)治療兒童難治性神經母細胞瘤。結果顯示,一些患者在接受輸注后出現了不同程度的緩解,在治療和隨訪過程中沒有發生藥物毒性或不良事件,表明 MSC-OV 治療的有效性和安全性。
此外,還有正在進行的臨床試驗。一項 I/II 期臨床試驗(NCT02068794)正在評估脂肪 MSC 使用溶瘤性麻疹病毒治療復發性卵巢癌癥、原發性腹膜癌癥或癌癥的療效、不良反應和最佳劑量。
另一項 I 期臨床試驗(NCT0389996568)評估了負載溶瘤腺病毒 DNX-2401 的 hBM-MSC 用于動脈內給藥治療復發性高級別膠質瘤患者的最佳劑量和副作用。此外,在 I/II 期臨床試驗(NCT05047276)中檢查了 AloCELYVIR 治療轉移性葡萄膜黑色素瘤肝轉移患者的安全性和有效性。
期待這些臨床試驗的結果!
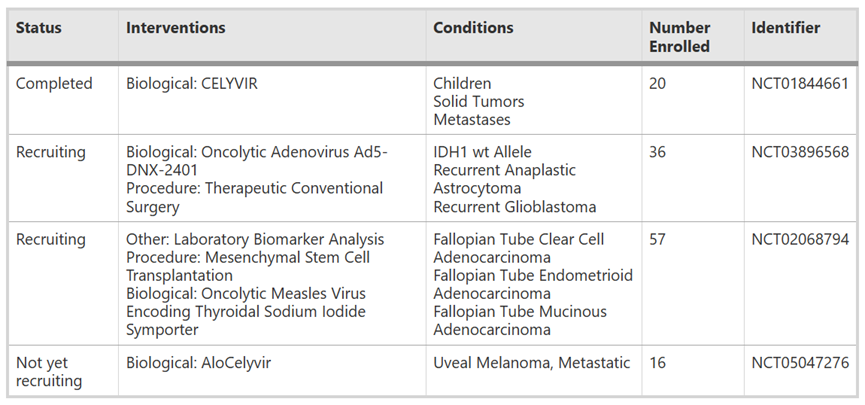
注:MSC-OV 在癌癥患者中的應用臨床試驗
盡管 MSC 作為 OV 細胞載體的研究數量有限,但目前的大多數結果看起來都很有希望。值得注意的是,目前關于 MSC 遞送溶瘤病毒治療實體瘤的研究大多處于早期階段,其安全性和有效性必須通過長期深入研究和大量臨床研究數據來證明。
路徑三:間充質干細胞抑制癌癥藥物副作用
大阪大學的相關研究人員發現:免疫檢查點抑制劑被廣泛用于治療多種癌癥,但有一個嚴重的副作用,那就是 1 型糖尿病的發病。現在,大阪大學的研究人員發現,間充質干細胞治療可以預防這種副作用。

大阪大學的 Emi Kawada Horitani 和其他研究人員構建了一個 1 型糖尿病小鼠模型,該模型接近免疫抑制劑的副作用。他們通過尾靜脈將人脂肪來源的間充質干細胞注射到小鼠體內。在建模后的第 16 天,他們分析了胰腺的組織學,發現注射間充質干細胞的小鼠的大多數胰島保持了正常的形狀和胰島素活性。然而,未經治療的小鼠表現出胰島變形和部分缺失。
定量分析胰腺切片中殘留的胰島 β 在測量細胞面積時發現,間充質干細胞組小鼠的胰島 β 與未經處理的小鼠相比,細胞數量顯著增加,證實了間充質細胞在胰島及其發育中的作用 β 細胞的保護和修復作用。
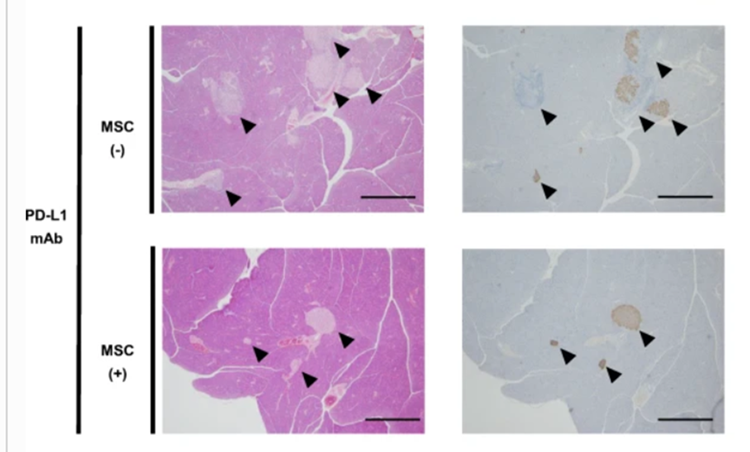
接下來,研究人員研究了注射的間充質干細胞的組織定位和血漿外泌體水平。組織定位顯示,胰腺、脾臟和肝臟中很少或沒有可見的熒光標記的間充質干細胞,而血漿中發現了來源于間充質干細胞衍生的外泌體。基于此,推測間充質干細胞可能通過分泌相關因子來實現修復胰腺島細胞的功能。
利用間充質干細胞抑制癌癥藥物副作用的一個好處是,間充質細胞及其分泌因子對癌癥也有一定的治療作用,一舉兩得。
間充質干細胞治療在臨床試驗中的應用越來越多。它不僅可以用于治療癌癥,還可以抑制癌癥藥物的副作用,為間充質干細胞治療帶來新的機遇。相信在不斷的研究中,間充質干細胞治療抗癌將逐步走向臨床,成為人類抗癌的有力工具。
免責聲明:我們尊重原創,也注重分享。圖文來源網絡,版權歸原作者所有,如涉及作品內容、版權或其它問題,請聯系我們刪除!


 閩公網安備 35020602002648 號
閩公網安備 35020602002648 號 QQ 客服
QQ 客服
