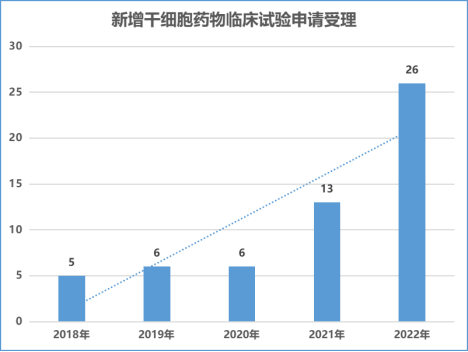
2018 年以來,國家藥品監督管理局重新受理干細胞新藥臨床試驗申請,干細胞藥物臨床試驗申請數量穩步增長。從受理申請數量來看,申請數量從 2018 年的 5 個(以受理申請數量為基礎)增加到 2022 年的 26 個,是 2021 的兩倍,中國新型干細胞藥物研發速度顯著加快。
▲干細胞藥品申報詳情
01 干細胞藥物臨床試驗申報情況
2022 年,CDE 共受理了 26 項干細胞藥物臨床申請(以受理數量為準),包括 25 項國內 1 類創新藥物注冊申請和 1 項進口 1 類創新藥注冊申請。
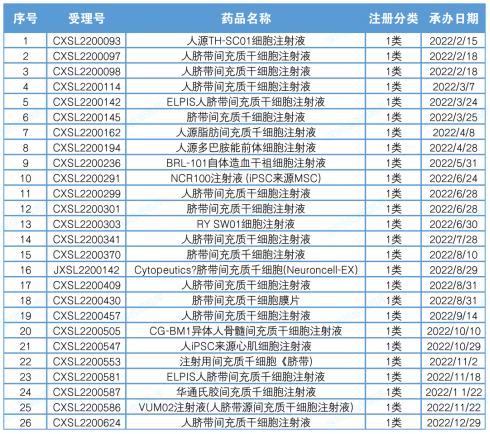
▲2022年度干細胞藥物注冊申報受理一覽表
02 臨床試驗默示許可情況
2022 年,來自 11 家企業的 11 種干細胞藥物的 16 項臨床試驗獲得了 CDE 默示許可。其中,上海愛薩爾生物的人臍血間充質干細胞注射液已獲批 2 項默示臨床試驗,泉生生物的人臍帶血間充質造血干細胞注射液獲批 4 項隱性臨床實驗。
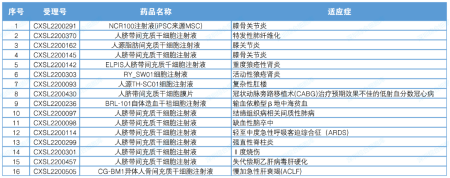
▲2022年度干細胞藥物臨床試驗默示許可覽表
03 臨床試驗適應證分析
截至 2022 年 12 月 31 日,CDE 已默認 42 項臨床試驗,涉及 20 個適應癥。排名前三的是膝關節炎(七項)、間質性肺病(五項)和移植物抗宿主病(四項)。其中,6 家企業的 7 種干細胞藥物用于治療膝關節骨性關節炎。干細胞的類型包括:自體脂肪間充質干細胞(一種)、同種異體脂肪間充干細胞(兩種)、臍帶間充質細胞(三種)和 iPSC 衍生的間充質造血干細胞(一種)。
在適應癥方面,大多數藥物使用間充質干細胞的免疫調節功能來治療炎癥或自身免疫性疾病。
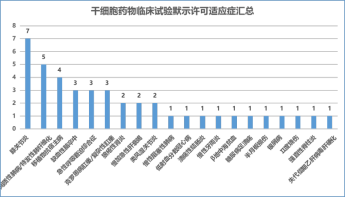
▲干細胞藥品適應證詳情
04 申報地區情況分析
在各省市的干細胞藥物應用中,截至 2022 年 12 月 31 日,共受理 56 項申請,42 項臨床試驗申請獲得隱性許可。
在申請受理方面,上海以 16 項排名第一,北京以 9 項排名第二,廣東、江蘇和天津緊隨其后。在臨床試驗的默示許可方面,上海仍以 13 項排名第一,北京以 9 項排名第二,江蘇、天津和廣東緊隨其后。可以看出,上海是干細胞藥物研發最活躍的地區,而長三角、北京、天津和廣東是中國干細胞藥物研究和開發的主要地區。
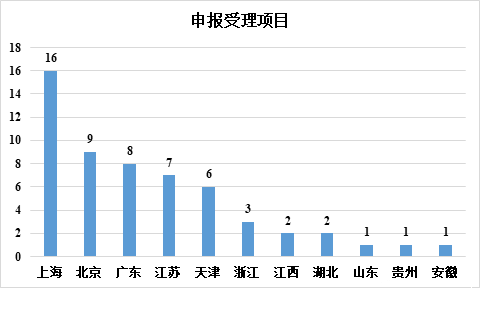
▲各省市干細胞藥品申報受理情況
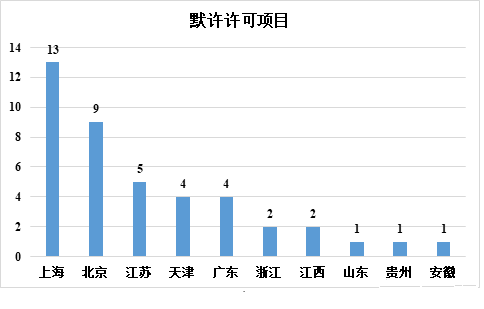
▲各省市干細胞藥品臨床試驗默示許可情況
05 申報的干細胞類型分析
截至 2022 年 12 月 31 日,根據申報的干細胞類型,人類臍帶間充質干細胞藥物有 32 種,占 61.5%,是干細胞藥物研發中最重要的細胞類型。特別是 2022 年,共受理 19 種臍帶間充質干細胞藥物,迎來大幅增長。其次,除了間充質干細胞,來自人類胚胎干細胞(ESC)和人類誘導多能干細胞(iPSC)的衍生細胞藥物也在穩步增長。2022 年,添加了三種 iPSC 衍生的細胞藥物。
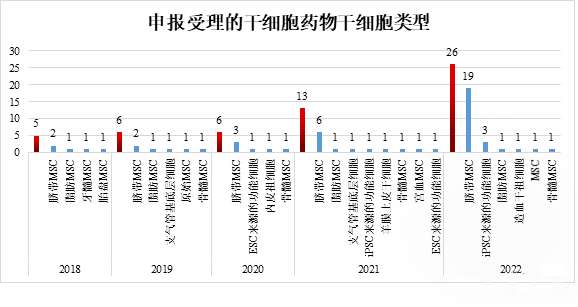
▲申報受理的干細胞藥物干細胞類型情況
在基礎研究領域,全球細胞治療領域取得了許多重大原創成果。中國干細胞基礎研究走在世界前列,為治療許多疑難復雜疾病提供了新的希望。由于前期市場無序,我國干細胞的臨床研究和臨床試驗一度停滯,導致干細胞產業上游儲存業務相對成熟,中游開發和下游應用發展相對滯后。
隨著《干細胞臨床研究管理辦法(試行)》《干細胞制劑質量控制和臨床前研究指導原則(試行)和《細胞治療產品研究與評價指導原則(試行)》等政策的出臺,我國干細胞臨床轉化正逐步步入正軌,使用干細胞藥物作為轉化出口的路徑逐漸清晰。隨著政策的明確,經過一番探索,我國干細胞臨床轉化進入了有序發展階段,干細胞藥物的數量和質量都有了明顯提高。
據信,2023 年將是干細胞藥物研發的爆發期,更多具有新適應癥的干細胞藥物將進入臨床試驗階段。與此同時,正在進行的干細胞藥物的 I/II 期臨床試驗將逐漸產生結果。我相信,隨著干細胞技術的不斷發展,干細胞作為治療藥物將在不久的將來出現。
免責聲明:
我們尊重原創,也注重分享。圖文來源網絡,版權歸原作者所有,如涉及作品內容、版權或其它問題,請聯系我們刪除!


 閩公網安備 35020602002648 號
閩公網安備 35020602002648 號 QQ 客服
QQ 客服
