近日,細胞治療先驅企業 Mesoblast 宣布,FDA 接受了該公司為間充質干細胞療法 remestemcel-L 重新遞交的生物制品許可申請(BLA),用于治療類固醇難治性急性移植物抗宿主病(SR-aGVHD)兒科患者。如果獲得批準,該療法將成為 FDA 批準的首款“現貨型”細胞療法,并且是治療 12 歲以下 SR-aGVHD 兒童的首個獲批療法。

01 關于 Mesoblast
Mesoblast 是開發同種異體(現貨)細胞藥物的世界領先者。該公司利用其專有的間充質譜系細胞治療技術平臺,建立了廣泛的后期候選產品組合,這些候選產品通過釋放抗炎因子來對抗和調節免疫系統,從而對嚴重炎癥做出反應,減少體內破壞性炎癥的發生。
Mesoblast 擁有強大而廣泛的全球知識產權組合,旗下所有產品的主要市場保護期至少延長至 2041 年。該公司的專有制造工藝可冷凍保存、規模化生產現成的細胞藥物。這些細胞療法具有明確的藥用標準,計劃隨時可供全球患者使用。

02 關于 Remestemcel-L
Mesoblast 的主要候選產品 remestemcel-L 是一種經過培養和擴增的間充質干細胞,這些細胞來源于骨髓捐獻,移植方式是通過靜脈輸注給藥于患者。
Remestemcel-L 被認為具有免疫調節特性,可通過下調促炎細胞因子的產生、增加抗炎細胞因子的產生以及募集天然存在的抗炎因子來抵消 SR-aGVHD 中涉及的炎癥過程細胞和受累組織。
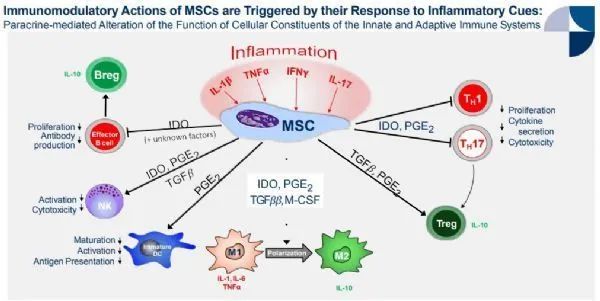
▲ 間充質干細胞的抗炎和免疫調節機制
03 關于移植物抗宿主病(GVHD)
大約 50% 接受同種異體骨髓移植(BMT)的患者會發生急性 GVHD。全世界每年有超過 30000 名患者接受同種異體 BMT,主要是治療血癌,其中約 20% 是兒科患者。SR-aGVHD 的死亡率高達 90%。目前仍然缺乏針對 12 歲以下兒童的任何合法的治療方案,這意味著迫切需要一種能夠改善慘淡生存結果的療法。
04 關于 Remestemcel-L 的上市之路
2020 年 1 月,Mesoblast 遞交了該產品的上市申請。
2020 年 8 月,Remestemcel-L 治療類固醇難治性急性移植物抗宿主病兒童患者的療效獲得美國 FDA 腫瘤藥物咨詢委員會 9:1 的壓倒性支持,該事件也受到了醫療界的廣泛關注。而 FDA 最終駁回了 Mesoblast 的上市文件,盡管其咨詢委員會投票認為其臨床數據能夠支撐上市,但 FDA 要求該公司提供更多臨床數據,至少包括一項額外的隨機臨床試驗數據。
據悉,在初次遞交數據時,Remestemcel-L 已經過了 10 余年的臨床研究,其中主要研究項目有三項:
● GvHD001/002 研究
GvHD001/002 研究是一項在美國 20 個試驗站點開展的涉及 55 名兒童的 3 期單臂試驗,Remestemcel-L 被作為一線療法,以治療類固醇療法無效的兒童 aGvHD 患者。與 275 研究的研究結果一致,該研究第 28 天總緩解率達到 70%,與預先指定的 45% 控制值(70.4% VS 45%,P=0.0003)相比,這更具有統計學意義。
● 275 研究
該項研究覆蓋了 8 個國家/地區的 50 個中心,納入了 241 名兒童 SR-aGvHD 患者,主要終點是第 28 天的總反應(OR) 在 65% 的患者中實現。試驗結果顯示,第 100 天的總體存活率為 67%,其中沒有達到第 28 天 OR 的患者第 100 天的總體存活率為 39%,相比之下,達到第 28 天 OR 的患者 100 天內的存活率更高,達到 82%。
● 280 研究
該研究是一項在 7 個國家/地區的 72 個試驗站點進行的,涉及 260 名患者(其中包括 28 名兒童)的 3 期隨機安慰劑對照試驗,Remestemcel-L 或安慰劑作為二線治療,以治療 SR-aGvHD 患者。在疾病程度最嚴重的兒童和成年患者中,與安慰劑組相比,Ryoncil 治療組第 28 天總緩解率達到 58%,對照組為 37%。在標準風險患者中,Ryoncil 治療沒有顯著的益處。該研究的兒童患者中,Ryoncil 治療組與安慰劑組相比,第 28 天總緩解率明顯更高,達到 64%,而安慰劑組為 36%。

▲ Mesoblast候選產品及進展階段
從首次遞交到現在已經過了 3 年,這三年里 Mesoblast 多次與 FDA 溝通上市事宜,多次被拒。此次遞交的試驗數據終于得到了 FDA 認可,FDA 認為此次重新提交的數據是一個完整的數據,并將處方藥用戶費用法案(PDUFA)日期定為 2023 年 8 月 2 日。
此次遞交的新的試驗數據,包括來自高風險兒童的傾向性匹配研究,數據將3期試驗中 25 名接受 remestemcel-L 治療的兒童的療效數據與西奈山醫院數據庫中 27 名未接受 remestemcel-L 治療的兒童進行了比較。分析顯示,67% 的 remestemcel 治療患者在 28 天內反應積極,六個月后存活,而數據庫中只有 10% 的患者具有相同的結果。
在重新補充提交的數據中,還包含國際血液和骨髓移植研究中心(CIBMTR)對參加 3 期試驗的 51 名可評估 SR-aGVHD 患者進行的 4 年生存研究的結果。結果證明了早期 180 天生存獲益的持久性,在一組主要患有 C/D 級疾病的兒童中,1 年生存率為 63%,2 年生存率為 51%。歷史上這些患者的 2 年預期生存率為 25-38%。
新數據可以充分證明生產工藝的一致性和可重復性,以及根據廣泛的臨床數據建立新的商業產品發布規范,從而保證未來每個批次的 remestemcel-L 的穩定性。
基于現有研究數據,FDA 授予了 remestemcel-L 快速通道指定。Mesoblast 頗為艱難的上市之路也給了我們一定的信號:即使療效得到了認可,即使所針對的疾病仍然處于一種無藥可治的狀態,但 FDA 對于干細胞這種新興的治療技術仍然持一種相對保守的態度。
在這三年多的時間里,Mesoblast 百折不撓,不斷地與 FDA 進行“溝通”,FDA 不斷地給到一些建議,然后 Mesoblast 根據這些建議不斷地改進臨床試驗或是做新的試驗,最終補足了 FDA 所要求的試驗數據才得以再度申報上市。這反映了新的治療手段想要獲批必須得到充分的療效和安全性數據驗證,且必須注重和監管機構的溝通。
免責聲明:
我們尊重原創,也注重分享。圖文來源網絡,版權歸原作者所有,如涉及作品內容、版權或其它問題,請聯系我們刪除!


 閩公網安備 35020602002648 號
閩公網安備 35020602002648 號 QQ 客服
QQ 客服
