近年來(lái),我國(guó)不斷更新對(duì) MSCs 產(chǎn)品作為藥物管理的規(guī)定。本文重點(diǎn)介紹 MSCs 產(chǎn)品開(kāi)發(fā)過(guò)程中面臨的流程和監(jiān)管挑戰(zhàn),旨在提供滿足監(jiān)管需求的策略。
本文重點(diǎn)介紹了中國(guó)異體間充質(zhì)干細(xì)胞藥物開(kāi)發(fā)的全過(guò)程,包括法規(guī)、指南、工藝、質(zhì)量管理、IND 前會(huì)議和 IND 申請(qǐng)以便獲得臨床試驗(yàn)許可。
01 間充質(zhì)干細(xì)胞基本情況
MSCs 來(lái)源廣泛,包括骨髓、脂肪、牙髓、臍帶、胎盤、羊膜、子宮內(nèi)膜組織、臍帶血、外周血、角膜緣等人類組織。回顧過(guò)去二十年,MSCs 由于其抗炎、促進(jìn)血管生成、免疫調(diào)節(jié)以及在特定條件下的多系分化能力,已成為臨床治療最有前景的候選細(xì)胞之一。MSCs 具有免疫豁免屬性,給藥前不需要 HLA 匹配。從少量的起始生物材料開(kāi)始,大規(guī)模擴(kuò)增相對(duì)容易。體內(nèi)研究已經(jīng)很好地證明了 MSCs 的療效、有效性和穩(wěn)定性,以支持潛在的臨床應(yīng)用。
全球有800多項(xiàng)已注冊(cè)的 MSCs 藥物臨床研究和 55000 多份 MSCs 相關(guān)文獻(xiàn)。目前,人們?cè)絹?lái)越需要了解 MSCs 作為藥品開(kāi)發(fā)相關(guān)的法規(guī)問(wèn)題。大多數(shù) MSCs 產(chǎn)品符合國(guó)際細(xì)胞治療協(xié)會(huì)(ISCT)在2006年定義的 MSCs 的最小標(biāo)準(zhǔn),包括細(xì)胞表面標(biāo)記物(即 CD105、CD73、CD90)的高表達(dá),與造血細(xì)胞相關(guān)的標(biāo)記物(如 CD45、CD34、CD14、CD19 和 HLA-DR)的低表達(dá),以及三系分化潛能。細(xì)胞標(biāo)志物在描述給定適應(yīng)癥的 MSCs 細(xì)胞產(chǎn)物時(shí)缺乏特異性。盡管世界上大多數(shù)監(jiān)管機(jī)構(gòu)不要求將純化的 MSCs 作為臨床產(chǎn)品,但在 MSCs 產(chǎn)品的開(kāi)發(fā)過(guò)程中考慮細(xì)胞標(biāo)志物時(shí),需要確定一致性和純度。
在美國(guó),根據(jù)《公共衛(wèi)生服務(wù)法》(PHS法案;42 U.S.C.262)第351條,培養(yǎng)和擴(kuò)增的MSC產(chǎn)品需要向美國(guó)食品藥品監(jiān)督管理局提交IND申請(qǐng),以獲得進(jìn)行臨床試驗(yàn)的許可。在歐盟,基于MSC的治療產(chǎn)品的開(kāi)發(fā)和授權(quán)由歐洲藥品管理局(EMA)監(jiān)管。EMA成立了高級(jí)治療委員會(huì)(CAT),負(fù)責(zé)審查和許可MSC治療產(chǎn)品。在中國(guó),根據(jù)現(xiàn)行監(jiān)管規(guī)定,MSCs在臨床研究中的使用可以通過(guò)兩個(gè)渠道獲得許可。一是衛(wèi)生健康委落實(shí)細(xì)胞治療產(chǎn)品臨床研究相關(guān)規(guī)定,批準(zhǔn)通過(guò)倫理委員會(huì)審核的定點(diǎn)醫(yī)院開(kāi)展MSCs臨床研究。其次,如果申請(qǐng)人打算開(kāi)發(fā)MSCs藥物,使用MSCs產(chǎn)品的臨床試驗(yàn)需要根據(jù)NMPA法規(guī)獲得CDE監(jiān)管的IND申請(qǐng)和許可證。IND申請(qǐng)必須由申請(qǐng)人提交,并提供全面的信息(包括細(xì)胞和制造工藝的開(kāi)發(fā)、質(zhì)量標(biāo)準(zhǔn)、質(zhì)量控制、MSCs產(chǎn)品的穩(wěn)定性研究、藥理學(xué)研究、安全性和毒性研究,以及臨床試驗(yàn)計(jì)劃和方案)。根據(jù)IND申報(bào)規(guī)定,MSC產(chǎn)品必須在符合GMP的實(shí)驗(yàn)室生產(chǎn)。
本文有助于 MSCs 產(chǎn)品開(kāi)發(fā)人員熟悉獲得IND申請(qǐng)?jiān)S可的流程和監(jiān)管問(wèn)題。
02 間充質(zhì)干細(xì)胞產(chǎn)品開(kāi)發(fā)流程
一般來(lái)說(shuō),MSCs 治療產(chǎn)品的開(kāi)發(fā)包括幾個(gè)關(guān)鍵階段,如下所示:
基礎(chǔ)研究包括:MSCs 的分離、純化、細(xì)胞特性分析、細(xì)胞培養(yǎng)基的開(kāi)發(fā)、擴(kuò)增和擬定適應(yīng)癥的作用機(jī)制(MOA)。
藥學(xué)研究主要包括:化學(xué)生產(chǎn)控制、產(chǎn)品檢測(cè)與放行、穩(wěn)定性程序等。
藥理學(xué)研究主要包括:確定目標(biāo)適應(yīng)癥,鞏固預(yù)期的作用機(jī)制,確定給藥途徑,確定生物活性劑量,確定療效,證明安全性和藥代動(dòng)力學(xué),等等。
毒理學(xué)研究應(yīng)考慮:?jiǎn)蝿┝慷拘栽囼?yàn)、重復(fù)給藥毒性試驗(yàn)、致瘤性研究、遺傳毒性試驗(yàn)、生殖毒性試驗(yàn)、抗原性試驗(yàn)、免疫毒性試驗(yàn)和局部耐受性等。
IND 申請(qǐng)包括 IND 前會(huì)議、IND 申報(bào)材料撰寫和 IND 提交。
臨床試驗(yàn)包括探索性臨床試驗(yàn)和驗(yàn)證性臨床試驗(yàn)。
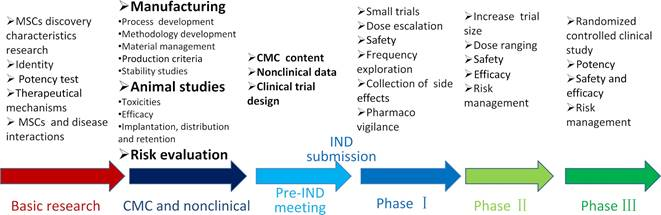
注:間充質(zhì)干細(xì)胞(MSCs)產(chǎn)品開(kāi)發(fā)流程圖
03 適用于間充質(zhì)干細(xì)胞產(chǎn)品的法規(guī)和指南
所有供人使用藥品的開(kāi)發(fā)都要求生物技術(shù)公司符合必須遵守的法律要求。
在美國(guó),MSCs 和其他細(xì)胞藥物由美國(guó)食品藥品監(jiān)督管理局生物產(chǎn)品評(píng)估與研究中心(CBER)監(jiān)管,特別是細(xì)胞組織和基因治療辦公室(OCGTT),該辦公室根據(jù)《美國(guó)聯(lián)邦法規(guī)》第 21 卷第 1271 部分規(guī)管人類細(xì)胞、組織、細(xì)胞和基于組織的產(chǎn)品。
在歐盟,MSCs 和其他細(xì)胞藥物屬于先進(jìn)療法(ATMP)的范疇,包括體細(xì)胞治療藥物、基因治療藥物和組織工程產(chǎn)品。
在日本,自 2014 年以來(lái),人類細(xì)胞、基因或組織來(lái)源的醫(yī)療藥物一直受到《藥品和醫(yī)療器械法案》(PMD 法案)的監(jiān)管。
在中國(guó),最早以《中華人民共和國(guó)藥品管理法》為指導(dǎo),于 1984 年全國(guó)人民代表大會(huì)首次頒布并于 2019 年進(jìn)行了修訂。隨后,國(guó)家藥品監(jiān)督管理局依法成立。NMPA 負(fù)責(zé)制定藥品質(zhì)量標(biāo)準(zhǔn)、藥品管理?xiàng)l例和安全監(jiān)督管理。NMPA 已經(jīng)建立了一個(gè)藥物審評(píng)中心(CDE),用于藥物審查和評(píng)估。中國(guó)所有的細(xì)胞治療,包括干細(xì)胞產(chǎn)品、免疫細(xì)胞產(chǎn)品和基因修飾細(xì)胞產(chǎn)品,均可參考 NMPA 2017 年發(fā)布的《細(xì)胞治療產(chǎn)品研究與評(píng)價(jià)技術(shù)指導(dǎo)原則(試行)》規(guī)范。
2020 年 4 月 26 日,NMPA 更新了《藥品生產(chǎn)質(zhì)量管理規(guī)范(GMP)》的生物制品附錄。NMPA 還起草了《藥品生產(chǎn)質(zhì)量管理規(guī)范(GMP)》(征求意見(jiàn)稿)中的細(xì)胞治療產(chǎn)品附錄。2020 年 8 月 4 日,NMPA 還起草了《人源性干細(xì)胞及其衍生細(xì)胞治療產(chǎn)品臨床試驗(yàn)技術(shù)指導(dǎo)原則(征求意見(jiàn)稿)》。新藥的開(kāi)發(fā)還必須符合現(xiàn)行《中國(guó)藥典》和其他國(guó)家藥品標(biāo)準(zhǔn)。此外,2017 年,NMPA 作為新成員加入了國(guó)際人用藥品注冊(cè)技術(shù)協(xié)調(diào)會(huì)(ICH),ICH 發(fā)布的所有指南都將獲得 NMPA 的批準(zhǔn)。
因此,藥品開(kāi)發(fā)企業(yè)可以參考 ICH 指南。有關(guān)細(xì)胞治療的更多信息,請(qǐng)參閱美國(guó)FDA、歐盟 EMA、美國(guó)注射劑協(xié)會(huì)(PDA)、美國(guó)的人體細(xì)胞組織優(yōu)良操作規(guī)范(GTP)和國(guó)際制藥工程學(xué)會(huì)(ISPE)的相關(guān)法規(guī)和指導(dǎo)文件。
04 化學(xué)、制造和控制(CMC)
一、質(zhì)控體系的建立與實(shí)施
GMP 是一種質(zhì)量保證體系,用于確保 MSCs 產(chǎn)品的持續(xù)生產(chǎn)和控制符合適用于臨床的最先進(jìn)的質(zhì)量標(biāo)準(zhǔn)。因此,臨床級(jí) MSCs 應(yīng)遵循 GMP 指南,并按照 IND 法規(guī)和質(zhì)量要求生產(chǎn)藥物。GMP 原則是為消費(fèi)者和患者提供質(zhì)量一致、安全性高的產(chǎn)品。為了滿足這些原則,制造商必須建立、實(shí)施和維護(hù)藥品質(zhì)量體系。藥品質(zhì)量體系應(yīng)監(jiān)督所有活動(dòng)(從原材料進(jìn)廠的控制、生產(chǎn)、測(cè)試、人員、設(shè)備、標(biāo)識(shí)、生產(chǎn)記錄審查、錯(cuò)誤檢測(cè)和糾正以及產(chǎn)品最終放行的授權(quán))。確定并實(shí)施適當(dāng)?shù)漠a(chǎn)品質(zhì)量改進(jìn)、工藝改進(jìn)、可變性降低、創(chuàng)新和藥品質(zhì)量體系改進(jìn),以增強(qiáng)持續(xù)滿足藥品質(zhì)量要求的管理能力,質(zhì)量風(fēng)險(xiǎn)管理有助于確定持續(xù)改進(jìn)的方向和優(yōu)先級(jí)。
臨床級(jí) MSCs 產(chǎn)品的生產(chǎn)依賴于訓(xùn)練有素且符合崗位要求的員工,這是 GMP 質(zhì)量體系的重要組成部分。中國(guó) GMP 的期望是,參與生產(chǎn)和管理各個(gè)方面的員工將接受系統(tǒng)的教育、持續(xù)的培訓(xùn)和定期的評(píng)估。負(fù)責(zé)人應(yīng)具有具體的職責(zé)和充分的授權(quán)來(lái)履行其職責(zé)。此外,《藥品生產(chǎn)質(zhì)量管理規(guī)范(GMP)》的附錄《細(xì)胞治療產(chǎn)品(征求意見(jiàn)稿)》對(duì)關(guān)鍵員工的資質(zhì)要求更高、更詳細(xì),包括產(chǎn)品生產(chǎn)負(fù)責(zé)人、質(zhì)量負(fù)責(zé)人和質(zhì)量受權(quán)人。
MSCs 產(chǎn)品生產(chǎn)環(huán)境和設(shè)施的空氣清潔度水平應(yīng)適合產(chǎn)品和生產(chǎn)操作,生產(chǎn)環(huán)境和設(shè)備不應(yīng)對(duì)原材料、中間體和成品造成污染。MSCs 產(chǎn)品的生產(chǎn)環(huán)境和設(shè)施應(yīng)易于清潔和消毒。此外,有必要對(duì) MSCs 產(chǎn)品的生產(chǎn)環(huán)境和設(shè)施進(jìn)行持續(xù)監(jiān)控。MSCs產(chǎn)品生產(chǎn)環(huán)境和設(shè)施的清潔、消毒、維護(hù)和監(jiān)控操作必須定期驗(yàn)證并持續(xù)控制。生產(chǎn)設(shè)備的設(shè)計(jì)、定位和維護(hù)應(yīng)符合其預(yù)期目的和用途。生產(chǎn)、測(cè)量、稱重、記錄和控制設(shè)備應(yīng)在規(guī)定的時(shí)間間隔內(nèi)通過(guò)適當(dāng)?shù)姆椒ê秃细竦臋C(jī)構(gòu)進(jìn)行維護(hù)、校準(zhǔn)和檢查。
CDE 主要通過(guò)申請(qǐng)人的文件系統(tǒng)獲得 GMP 合規(guī)性。這必須涉及操作和質(zhì)量管理的各個(gè)方面,以便能夠?qū)徲?jì)與產(chǎn)品制造和質(zhì)量控制相關(guān)的所有活動(dòng)。此外,《藥品GMP》(2010 年修訂)第 8 章規(guī)定,文件是質(zhì)量保證體系的重要組成部分,生產(chǎn)企業(yè)必須有書面的管理程序、質(zhì)量標(biāo)準(zhǔn)、技術(shù)指南、制劑處方和工藝規(guī)程、標(biāo)準(zhǔn)操作規(guī)程,并準(zhǔn)確記錄內(nèi)容。企業(yè)應(yīng)建立管理和操作程序的文件管理程序,包括文件的系統(tǒng)設(shè)計(jì)、編制、審查、批準(zhǔn)和發(fā)布。質(zhì)量管理部門應(yīng)審查與本規(guī)范有關(guān)的文件。文件內(nèi)容應(yīng)與藥品生產(chǎn)許可證和藥品注冊(cè)的相關(guān)要求一致,并有助于追溯每批產(chǎn)品的歷史記錄。
二、物料管理
材料是指用于制造 MSCs 產(chǎn)品的原料或材料(包括細(xì)胞、平衡鹽溶液、蛋白酶、血清、培養(yǎng)基、細(xì)胞因子、各種添加劑、冷凍保存試劑、轉(zhuǎn)基因材料、輔料、培養(yǎng)瓶、細(xì)胞冷凍保存袋等)。生產(chǎn)物料與 MSCs 產(chǎn)品的質(zhì)量直接相關(guān),因此,物料管理必須建立在良好和標(biāo)準(zhǔn)化的質(zhì)量保證和評(píng)估體系的基礎(chǔ)上(包括風(fēng)險(xiǎn)評(píng)估、關(guān)鍵材料制造商和供應(yīng)商的資格審查、質(zhì)量放行測(cè)試的開(kāi)發(fā)和改進(jìn)等)。物料的來(lái)源、成分、用途、用量和質(zhì)量控制應(yīng)清晰合理。在選擇材料時(shí),應(yīng)考慮必要性、合理性和安全性,并開(kāi)展工藝去除效果驗(yàn)證和安全風(fēng)險(xiǎn)評(píng)估,如有必要,應(yīng)對(duì)材料殘留進(jìn)行測(cè)試放行。優(yōu)先使用已被批準(zhǔn)供人類使用或符合藥典標(biāo)準(zhǔn)的材料是非常重要的。對(duì)于生物來(lái)源材料(如 FBS 和人白蛋白),應(yīng)對(duì)外源因子進(jìn)行全面檢查,并在技術(shù)開(kāi)發(fā)中考慮新外源因子的知識(shí)。使用自體細(xì)胞治療產(chǎn)品應(yīng)嚴(yán)格防止外源因子擴(kuò)散的可能風(fēng)險(xiǎn),材料管理信息應(yīng)在 IND 應(yīng)用程序的 CMC 部分提供,CDE 評(píng)審員將確定制造的適用性。
原料
用于分離和培養(yǎng)MSC的生物材料均來(lái)自捐贈(zèng)者,需要簽署醫(yī)院醫(yī)學(xué)研究倫理委員會(huì)批準(zhǔn)的知情同意書。每個(gè)捐獻(xiàn)者都需要接受人源病原體的篩查和檢測(cè),尤其是HIV、HBV 和 HCV。培養(yǎng)擴(kuò)增所需的所有起始材料和試劑都需要進(jìn)行測(cè)試,以證明這些材料是無(wú)菌的,不含內(nèi)毒素。
細(xì)胞分離和培養(yǎng)擴(kuò)增過(guò)程應(yīng)在 GMP 條件下進(jìn)行,并進(jìn)行驗(yàn)證以建立主細(xì)胞庫(kù)(MCB)。需要同時(shí)實(shí)施質(zhì)量控制,以確保儲(chǔ)存在主要細(xì)胞庫(kù)中的細(xì)胞經(jīng)過(guò)無(wú)菌、支原體和內(nèi)毒素檢測(cè)和監(jiān)測(cè)。因此,有必要建立明確的標(biāo)準(zhǔn)和要求(如細(xì)胞表面標(biāo)記物、培養(yǎng)條件的優(yōu)化、細(xì)胞運(yùn)輸量、生長(zhǎng)特性等)。原則上,對(duì)于從適合建立主細(xì)胞庫(kù)的生物材料中分離原代細(xì)胞,并有計(jì)劃進(jìn)行細(xì)胞檢測(cè)、保存和制造。細(xì)胞庫(kù)的水平可為根據(jù)細(xì)胞自身特點(diǎn)、生產(chǎn)狀況和臨床應(yīng)用綜合考慮建立細(xì)胞庫(kù)檢驗(yàn)標(biāo)準(zhǔn),檢驗(yàn)應(yīng)滿足安全性、質(zhì)量可控性和/或有效性的基本要求。
輔料
應(yīng)開(kāi)發(fā)和驗(yàn)證 MSCs 產(chǎn)品中輔料的使用、劑量和質(zhì)量,以證明其使用的必要性、安全性和合理性。建議優(yōu)先選擇已批準(zhǔn)用于人類藥物的輔料。否則,輔料的選擇需要進(jìn)行全面的研究和評(píng)估。此外,一個(gè)更好的選擇是在產(chǎn)品 IND 申請(qǐng)審查過(guò)程中對(duì)關(guān)鍵輔料進(jìn)行相關(guān)審查和批準(zhǔn)。
容器和封閉系統(tǒng)
為了避免產(chǎn)品質(zhì)量因儲(chǔ)存而發(fā)生意外變化,生產(chǎn)商應(yīng)在 MSCs 產(chǎn)品生產(chǎn)過(guò)程中對(duì)用于樣品儲(chǔ)存和/或成品的包裝容器和封閉系統(tǒng)進(jìn)行安全評(píng)估和兼容性研究。為了說(shuō)明其包裝容器和封閉系統(tǒng)使用的合理性,還需要研究其密封和冷凍儲(chǔ)存的適用性。MSCs 產(chǎn)品的生產(chǎn)過(guò)程(如收集的組織或細(xì)胞、制備過(guò)程中的細(xì)胞、成品的輸注等)可能涉及樣品和容器之間的短期直接接觸。生產(chǎn)商還應(yīng)進(jìn)行接觸式容器系統(tǒng)和 MSCs 產(chǎn)品之間的安全評(píng)估和兼容性研究。此外,建議在 IND 審查期間審查和批準(zhǔn)與藥物直接接觸的容器和封閉系統(tǒng)。
三、GMP 車間的 CMC
由于細(xì)胞在體內(nèi)存活、自發(fā)增殖或/和分化的能力,臨床研究和質(zhì)量控制應(yīng)充分考慮上述基本特征。MSCs 產(chǎn)品應(yīng)符合藥品質(zhì)量管理的一般要求。臨床樣品的整個(gè)生產(chǎn)過(guò)程是合理的,符合《藥品生產(chǎn)質(zhì)量管理規(guī)范(GMP)》的基本原則和相關(guān)要求。在生產(chǎn)過(guò)程和質(zhì)量控制中應(yīng)特別注意人員、環(huán)境、設(shè)備和其他要求。MSCs 產(chǎn)品的制造應(yīng)建立一個(gè)貫穿整個(gè)過(guò)程或生命周期的質(zhì)量保證和控制系統(tǒng)。生產(chǎn)過(guò)程應(yīng)經(jīng)過(guò)嚴(yán)格的工藝驗(yàn)證,并建立明確的關(guān)鍵控制點(diǎn)。嚴(yán)格控制生產(chǎn)材料,建立并驗(yàn)證 MSCs 產(chǎn)品生產(chǎn)現(xiàn)場(chǎng)的標(biāo)準(zhǔn)操作程序,以避免生產(chǎn)過(guò)程中原材料和生產(chǎn)的潛在外部或交叉污染。還應(yīng)采取有效的隔離措施,防止不同供應(yīng)商的產(chǎn)品或預(yù)期用途混淆。
制造
MSCs 產(chǎn)品的生產(chǎn)過(guò)程是指從供體材料中獲得細(xì)胞到完成細(xì)胞輸入受體體內(nèi)的體外操作。制造商必須進(jìn)行工藝開(kāi)發(fā)和驗(yàn)證,以證明工藝的可行性和可靠性。生產(chǎn)過(guò)程中的每一步都需要進(jìn)行控制,以確保成品符合包括規(guī)格在內(nèi)的所有質(zhì)量屬性。
工藝驗(yàn)證是指從工藝設(shè)計(jì)階段到商業(yè)生產(chǎn)的數(shù)據(jù)收集和評(píng)估。它建立了科學(xué)的證據(jù)來(lái)證明該過(guò)程可以持續(xù)交付高質(zhì)量的產(chǎn)品。工藝驗(yàn)證包括 MSCs 產(chǎn)品和工藝生命周期內(nèi)發(fā)生的一系列活動(dòng)。工藝設(shè)計(jì)應(yīng)避免細(xì)胞發(fā)生意外或異常變化,并滿足消除相關(guān)雜質(zhì)的要求。制定技術(shù)標(biāo)準(zhǔn)、工藝標(biāo)準(zhǔn)操作規(guī)程、關(guān)鍵工藝控制參數(shù)、內(nèi)部控制指標(biāo)和廢棄物標(biāo)準(zhǔn),并對(duì)整個(gè)生產(chǎn)過(guò)程進(jìn)行監(jiān)控。制造商應(yīng)繼續(xù)優(yōu)化生產(chǎn)工藝,減少物理、化學(xué)或生物效應(yīng)對(duì)細(xì)胞特性的意外影響,并減少雜質(zhì)(如使用蛋白酶、核酸酶和選擇性抑制劑)。如果在制造過(guò)程中存在不連續(xù)生產(chǎn),則應(yīng)確定并驗(yàn)證電池的儲(chǔ)存條件和持續(xù)時(shí)間。建議使用封閉或半封閉制備工藝,以降低污染和交叉污染的風(fēng)險(xiǎn)。
監(jiān)控整個(gè)生產(chǎn)過(guò)程,包括監(jiān)控關(guān)鍵工藝參數(shù)(CPP)和實(shí)現(xiàn)過(guò)程控制指標(biāo)。制造商應(yīng)根據(jù)對(duì)整個(gè)過(guò)程的理解和積累的產(chǎn)品經(jīng)驗(yàn),明確過(guò)程控制中的關(guān)鍵生產(chǎn)步驟,并建立有限的敏感參數(shù)范圍,以避免過(guò)程漂移。如有必要,還可以在生產(chǎn)過(guò)程中對(duì)細(xì)胞進(jìn)行質(zhì)量控制。生產(chǎn)過(guò)程中的質(zhì)量控制和細(xì)胞放行檢測(cè)是相互結(jié)合和互補(bǔ)的,以實(shí)現(xiàn)對(duì)整個(gè)過(guò)程和產(chǎn)品質(zhì)量的控制。由于供體材料的多樣性,它們可能含有傳染病病原體,并且這個(gè)過(guò)程可能會(huì)造成污染。應(yīng)特別注意在 MSCs 產(chǎn)品的整個(gè)制造過(guò)程中防止微生物污染。
MSCs 產(chǎn)品的劑型、處方和處方工藝應(yīng)根據(jù)臨床用藥要求和 MSCs 產(chǎn)品穩(wěn)定性確定。一些 MSCs 產(chǎn)品在給藥前需要經(jīng)過(guò)改變產(chǎn)品成分的物理狀態(tài)、容器轉(zhuǎn)換、過(guò)濾和清潔、與其他組織材料結(jié)合以及調(diào)整藥物劑量等步驟。因此,還應(yīng)開(kāi)發(fā)和驗(yàn)證這些工藝步驟,并在實(shí)際產(chǎn)品生產(chǎn)和應(yīng)用中嚴(yán)格執(zhí)行。應(yīng)提供 MSCs 生產(chǎn)中使用的組份和材料的制造信息,以及對(duì)這些材料進(jìn)行的檢測(cè)匯,應(yīng)提供制造過(guò)程中使用的所有組份的清單。對(duì)于異基因細(xì)胞,供體篩選和檢測(cè)信息應(yīng)表明所有供體都符合供體標(biāo)準(zhǔn),并且必須提供關(guān)于 MSCs 組織來(lái)源和分離、大規(guī)模擴(kuò)增以及收集培養(yǎng)的詳細(xì)說(shuō)明。細(xì)胞庫(kù)部分應(yīng)提供有關(guān)歷史、來(lái)源、衍生和特性的信息(包括確定細(xì)胞安全性、特性、純度和穩(wěn)定性的測(cè)試)。
在申請(qǐng) IND 時(shí),必須列出所有用于細(xì)胞生產(chǎn)的試劑信息(包括基礎(chǔ)培養(yǎng)基、細(xì)胞因子、生長(zhǎng)因子、抗生素、胎牛血清、緩沖液和蛋白酶等)。這些試劑可能會(huì)影響最終產(chǎn)品的安全性、有效性和純度,通常是外源性的。因此,應(yīng)控制和證明其來(lái)源、質(zhì)量、鑒定以及從最終產(chǎn)品中去除。制造商的質(zhì)量檢驗(yàn)報(bào)告(COA)、質(zhì)量標(biāo)準(zhǔn)和申請(qǐng)人的 COA 必須是材料管理的最重要信息之一。還應(yīng)列出最終產(chǎn)品中存在的輔料,并詳細(xì)解釋生產(chǎn)程序,并提供細(xì)胞產(chǎn)品的分離、傳代、純化、大規(guī)模擴(kuò)增、收集、制備、包裝和最終產(chǎn)品檢測(cè)的流程圖。此外,還應(yīng)詳細(xì)說(shuō)明細(xì)胞的制備、工藝時(shí)間、中間儲(chǔ)存和最終配方。
產(chǎn)品測(cè)試和放行
MSCs 產(chǎn)品的質(zhì)量研究應(yīng)貫穿整個(gè)開(kāi)發(fā)和規(guī)模化生產(chǎn)過(guò)程,從具有代表性的產(chǎn)品批次和適當(dāng)?shù)纳a(chǎn)階段中選擇樣品。質(zhì)量研究應(yīng)涵蓋各種細(xì)胞分析,包括功能、純度和安全性,并可根據(jù)產(chǎn)品特性和屬性增加其他相關(guān)研究項(xiàng)目。制造商必須制定 MSCs 產(chǎn)品的質(zhì)量標(biāo)準(zhǔn)和質(zhì)量控制策略,這些標(biāo)準(zhǔn)和策略應(yīng)符合 NMPA 批準(zhǔn)的藥品質(zhì)量標(biāo)準(zhǔn),即藥品注冊(cè)標(biāo)準(zhǔn)。藥品注冊(cè)標(biāo)準(zhǔn)應(yīng)符合現(xiàn)行《中國(guó)藥典》通用技術(shù)要求,且不得低于現(xiàn)行《中國(guó)藥典》的規(guī)定。如果申報(bào)的注冊(cè)品種所涉及的檢測(cè)項(xiàng)目和指標(biāo)不適用于現(xiàn)行《中國(guó)藥典》,生產(chǎn)商應(yīng)提供充分合理的支持?jǐn)?shù)據(jù),建議使用將中間樣品質(zhì)量檢驗(yàn)與最終產(chǎn)品放行試驗(yàn)相結(jié)合的機(jī)制。
MSCs 產(chǎn)品的分析程序和方法必須經(jīng)過(guò)系統(tǒng)驗(yàn)證和確認(rèn),申請(qǐng)人應(yīng)提交分析程序和方法驗(yàn)證和驗(yàn)證數(shù)據(jù),以支持 MSCs 細(xì)胞庫(kù)和 MSCs 產(chǎn)品的鑒定、活力、質(zhì)量、純度和效力的文件。為了達(dá)到預(yù)期目的,分析程序和方法的典型驗(yàn)證特性應(yīng)考慮以下因素:準(zhǔn)確度、精密度(包括重復(fù)性和中間精密度)、特異性、耐用性、檢出限、定量限、線性和范圍。分析報(bào)告應(yīng)包括原理、設(shè)備、操作參數(shù)、試劑、參考標(biāo)準(zhǔn)和材料、驗(yàn)收標(biāo)準(zhǔn)、樣品制備、穩(wěn)定性、標(biāo)準(zhǔn)制備、試驗(yàn)程序、系統(tǒng)適用性、計(jì)算、數(shù)據(jù)分析和結(jié)論。在 MSCs 產(chǎn)品的生命周期內(nèi),如果原材料、生產(chǎn)工藝、法定分析程序、國(guó)家標(biāo)準(zhǔn)和自行開(kāi)發(fā)的分析程序發(fā)生任何關(guān)鍵變化,強(qiáng)烈建議重新驗(yàn)證。此外,當(dāng)制造商提議用替代分析程序取代經(jīng)驗(yàn)證的分析程序時(shí),或者當(dāng)分析程序從一個(gè)實(shí)驗(yàn)室轉(zhuǎn)移到另一個(gè)實(shí)驗(yàn)室時(shí),要求采用具有可比性的分析方法。目前,分析方法驗(yàn)證的主要挑戰(zhàn)是中國(guó)甚至世界各地標(biāo)準(zhǔn)品和參考品的嚴(yán)重短缺。因此,為了解決標(biāo)準(zhǔn)品和參考品的嚴(yán)重短缺問(wèn)題,MSCs 產(chǎn)品制造商與標(biāo)準(zhǔn)品和參考品開(kāi)發(fā)機(jī)構(gòu)之間的密切合作是必要和緊迫的。
隨著研究的進(jìn)展,應(yīng)逐步積累與過(guò)程相關(guān)的信息,并改進(jìn)分析程序,以滿足每個(gè)階段的質(zhì)量控制要求。質(zhì)量控制通常應(yīng)考慮鑒定試驗(yàn)(細(xì)胞形態(tài)、表型、細(xì)胞標(biāo)記等)、生物學(xué)功效、純度、雜質(zhì)、細(xì)胞計(jì)數(shù)(活細(xì)胞計(jì)數(shù)、功能細(xì)胞計(jì)數(shù)等)、細(xì)胞生長(zhǎng)活性、細(xì)胞周期、細(xì)胞倍增時(shí)間、克隆形成率,以及一般檢測(cè)(如無(wú)菌檢測(cè)、支原體、內(nèi)毒素、端粒酶表達(dá)和活性等)。細(xì)胞特性研究應(yīng)基于細(xì)胞類型(包括細(xì)胞形態(tài)、細(xì)胞表面標(biāo)志物、基因表達(dá)、細(xì)胞分化、表面標(biāo)志物表達(dá)、效價(jià)測(cè)試、分泌組定性和定量測(cè)量,以及過(guò)程中添加成分的殘留量檢測(cè))。
應(yīng)根據(jù)細(xì)胞的性質(zhì)、特征和預(yù)期用途,制定 MSCs 產(chǎn)品功能研究的分析程序。為了建立合理有效的生物功效分析程序,作用機(jī)制應(yīng)與臨床適應(yīng)癥一致。就細(xì)胞純度而言,建議測(cè)試細(xì)胞亞群和活力。雜質(zhì)研究應(yīng)包括細(xì)胞加工(如蛋白酶、動(dòng)物血清蛋白、重組蛋白和細(xì)胞因子)以及最終細(xì)胞產(chǎn)物(如死細(xì)胞殘留物和其他可能的生物降解產(chǎn)物)。應(yīng)根據(jù)細(xì)胞來(lái)源和過(guò)程的特點(diǎn),考慮安全性相關(guān)研究,并可考慮外來(lái)病毒因素、細(xì)胞惡性轉(zhuǎn)化的可能性、遺傳穩(wěn)定性、致瘤性和致瘤性。
細(xì)胞給藥過(guò)程的模擬研究還需要進(jìn)一步的開(kāi)發(fā)和改進(jìn)。如果在醫(yī)院的研究中心進(jìn)行(細(xì)胞恢復(fù)、產(chǎn)品稀釋等),申請(qǐng)人應(yīng)制定標(biāo)準(zhǔn)操作程序,并為臨床研究人員提供良好的培訓(xùn)。強(qiáng)烈建議在完成給藥操作前完成標(biāo)準(zhǔn)化工藝驗(yàn)證測(cè)試,以驗(yàn)證最終產(chǎn)品質(zhì)量(如細(xì)胞形態(tài)、細(xì)胞表型、多系分化效力、細(xì)胞數(shù)量和存活率、外觀、療效、特性、無(wú)菌性、支原體、內(nèi)毒素、其他外源性物質(zhì)等)。效力評(píng)估,用于證明在臨床研究的所有階段和市場(chǎng)批準(zhǔn)后使用符合預(yù)定規(guī)范或驗(yàn)收標(biāo)準(zhǔn)的產(chǎn)品批次。一般來(lái)說(shuō),沒(méi)有一種單一的測(cè)試方法可以完全評(píng)估預(yù)測(cè)細(xì)胞和基因治療產(chǎn)品臨床療效的產(chǎn)品屬性。因此,開(kāi)發(fā)多屬性測(cè)試來(lái)評(píng)估細(xì)胞和基因治療產(chǎn)品的療效是必要和可取的。
每批產(chǎn)品都應(yīng)進(jìn)行放行檢驗(yàn),最終產(chǎn)品的質(zhì)量標(biāo)準(zhǔn)應(yīng)在 IND 中明確規(guī)定,通常采用表格的形式。最終放行檢查數(shù)據(jù)最好在 MSCs 產(chǎn)品臨床使用前提供。從細(xì)胞采集到臨床給藥,所有產(chǎn)品都必須具有可追溯性、可識(shí)別性和適當(dāng)?shù)臉?biāo)簽。
MSCs 產(chǎn)品的穩(wěn)定性研究
建議使用連續(xù)工藝生產(chǎn) MSCs 產(chǎn)品。對(duì)于生產(chǎn)過(guò)程中需要臨時(shí)儲(chǔ)存的樣品,應(yīng)進(jìn)行儲(chǔ)存穩(wěn)定性研究,以支持其儲(chǔ)存條件和保質(zhì)期。有必要進(jìn)行穩(wěn)定性測(cè)試,以證明最終細(xì)胞產(chǎn)物在研究所需的時(shí)間內(nèi)(從最終放行到給藥)足夠穩(wěn)定,并應(yīng)注明最終產(chǎn)品的有效期。MSCs 產(chǎn)品穩(wěn)定性研究的基本原則是根據(jù)產(chǎn)品本身的特點(diǎn)、臨床用藥需求以及儲(chǔ)存、包裝和運(yùn)輸?shù)倪\(yùn)輸條件,制定合理的研究計(jì)劃。應(yīng)使用具有代表性的細(xì)胞樣品和儲(chǔ)存條件進(jìn)行研究。此外,應(yīng)制定和優(yōu)化最終產(chǎn)品運(yùn)輸方案,并驗(yàn)證該方案的穩(wěn)定性。此外,還應(yīng)驗(yàn)證給藥前的產(chǎn)品準(zhǔn)備程序,以確認(rèn)最終產(chǎn)品質(zhì)量合格。
未完待續(xù)......
免責(zé)聲明:我們尊重原創(chuàng),也注重分享。圖文來(lái)源網(wǎng)絡(luò),版權(quán)歸原作者所有,如涉及作品內(nèi)容、版權(quán)或其它問(wèn)題,請(qǐng)聯(lián)系我們刪除!


 閩公網(wǎng)安備 35020602002648 號(hào)
閩公網(wǎng)安備 35020602002648 號(hào) QQ 客服
QQ 客服
