據國際糖尿病聯盟在 2021 年的估算數據:全球約有 5.37 億的成年人患有糖尿病相當于每 11 個人中就有一個糖尿病患者。預計到 2045 年,這一數字將達到 7 億,約 670 萬人會因此喪命。但實際上,糖尿病本身并不可怕,可怕的是隨之而來的并發癥 。
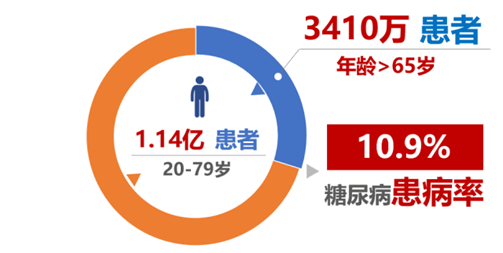
01 備受折磨的糖尿病患者
糖尿病是全球常見的慢性病之一,由胰島素分泌不足或胰島素利用障礙引起的碳水化合物、蛋白質、脂肪代謝紊亂性疾病,以高血糖為主要標志。糖尿病的主要表現就是血糖水平高(空腹血糖≥7.0mmol/L),并伴有“三多一少”的癥狀,即吃得多、喝得多、尿得多,但體重變少。按照致病因素不同,又可以分為 1 型糖尿病和 2 型糖尿病,遺傳因素和環境因素共同導致糖尿病的發生。
1 型糖尿病
又稱胰島素依賴型糖尿病,常在青少年階段發病,主要是由于免疫、遺傳、病毒感染等因素引起,發病機制可能是胰腺 β 細胞被破壞,不能正常分泌胰島素,導致胰島素缺乏或顯著減少,外周組織無法合理利用葡萄糖,從而出現高血糖,由此引發糖尿病。
1 型糖尿病不常見,典型臨床表現是“三多一少”,有時會出現酮癥酸中毒的癥狀(呼氣有爛蘋果氣味),一般采用外用注射胰島素控制。
2 型糖尿病
又叫非胰島素依賴型糖尿病,常在成人階段發病,是由于遺傳或者生活因素,引起機體胰島素抵抗、胰島素相對缺乏,進而引起血糖的持續升高。2 型糖尿病患者約占據我國糖尿病患者的 90%,其主要特征也為“三多一少”。和 1 型糖尿病不同,2 型糖尿病初期胰島素分泌正常,但是由于種種原因,胰島素無法發揮正常功能,血糖濃度降不下去,而高血糖又會刺激胰島細胞生成更多的胰島素。長久高強度運作下,最終導致胰島細胞出現“罷工”,胰島素分泌出現障礙,加重高血糖。
2 型糖尿病的發病機制復雜。就并發癥而言,1 型糖尿病容易引起的視網膜,腎和神經病變。2 型糖尿病容易發生心臟,腦,腎,足或肢體的血管動脈硬化病變。
2 型糖尿病一般多采用口服降糖藥以及胰島素注射配合治療,從而降低血糖濃度。
02 什么是胰島素
胰島素是由胰臟內的胰島 β 細胞分泌的一種蛋白質激素,是人體中唯一可以降低血糖的激素,兼有促進糖原、脂肪、蛋白質合成的作用。通俗來講,胰島素對葡萄糖代謝的作用,就是能將葡萄糖從細胞外轉移到細胞內,降低血糖水平。當胰島素分泌不足,血液中的葡萄糖就無法順利轉移到細胞內,從而引發高血糖。此時則需要通過注射外源胰島素來達到血糖平衡。
胰島素的生理作用主要是調節代謝過程,胰島素可以調節三大代謝物質:
調節糖代謝:胰島素可以促進組織細胞對葡萄糖的攝取和利用,促進糖原合成,抑制糖異生,從而使血糖降低。
調節脂肪代謝:胰島素可以促進脂肪的合成與貯存,可以使血液中的游離脂肪酸減少,同時抑制脂肪分解氧化。
調節蛋白質代謝:胰島素在促進蛋白質合成、貯存的同時,也可抑制蛋白質的分解。
胰島移植雖可以改善患者的胰島素不足問題,但是供源不足,且需要長期服用免疫抑制劑,臨床上無法大規模開展。干細胞技術的飛速發展,生物材料科學的進步,使再生醫學離臨床轉化越來越近,有望成為最有潛力的糖尿病替代治療策略。
03 干細胞治療糖尿病的兩大策略
干細胞療法為糖尿病患者帶來了新希望。干細胞治療糖尿病主要有兩大策略,如下:
第一類是功能性胰島細胞,作用是細胞替代,分泌生產胰島素。
利用多能干細胞(包括 hESC 和 iPSC),定向分化產生功能性類 β 細胞;
利用其它組織器官細胞(例如胃腸上皮細胞或胰腺外分泌細胞),通過重編程、轉分化獲得功能性類β細胞;
利用胰島成體干細胞產生胰島類器官,獲得各種胰島功能細胞。這些路徑的共同點是產生新的功能胰島細胞,直接代替依賴于捐贈者的供體胰島。
第二類是間充質干細胞,作用是調節免疫功能,保護患者體內的 β 細胞,改善胰島環境,從而減輕糖尿病癥狀。
間充質干細胞(MSCs)既能夠支持、保護 β 細胞,可能還是 β 細胞的來源之一。間充質干細胞移植對 2 型糖尿病(T2D)患者有效,但其在 1 型糖尿病(T1D)患者中的療效還存在爭議,因為間充質干細胞在體外分化為功能性 β 細胞的能力較差,且在體內沒有發生轉分化。
人胚胎干細胞來源的胰島移植,也進入了 I 期和 II 期臨床試驗。多能干細胞替代療法克服了供體不足的障礙,但仍面臨免疫排斥的風險。膠囊化細胞(將移植的胰島細胞包裹在膠囊內的免疫保護策略),通過多能干細胞來源的胰島類器官與膠囊、微膠囊技術相結合,建立一道免疫屏障,避免引起免疫排斥反應。但是這也有一定的問題要解決:β 細胞代謝非常旺盛,對氧氣和營養物質的需求很大,而免疫屏障讓移植細胞很難直接發生血管化。
總之,干細胞治療糖尿病是目前再生醫學領域中最備受關注的研究方向,但由基礎走向臨床的轉化過程中仍然道路曲折,面臨諸多挑戰。
04 干細胞為糖尿病患者帶來新的希望!
臨床證據證實了間充質干細胞(MSCs)在各種醫療條件下的治療益處。
目前,MSCs 是臨床試驗中最常用的干細胞。早在 2017 年,研究員在《Journal of Molecular Endocrinology》發表了綜述,總結 MSCs 在組織修復中的作用,提供改善 MSCs 功能的新策略,并描述這些過程如何轉化為糖尿病的臨床治療。

成果一:人多能干細胞來源的胰島細胞可有效恢復糖尿病患者胰島素水平低下的問題
2022 年 2 月 4 日,北京大學鄧宏魁研究組、中國醫學科學院/北京協和醫學院彭小忠研究組,以及天津市第一中心醫院沈中陽研究團隊,在國際權威期刊 Nature Medicine 上發表題為 Human Pluripotent Stem Cell-derived Islets Ameliorate Diabetes in Nonhuman Primates(人多能干細胞來源的胰島細胞改善非人靈長類糖尿病動物模型血糖控制的研究)的研究論文。
該研究首先在原有工作基礎上進一步優化和改進了人多能干細胞向胰島細胞的分化制備方案,成功完成了高效誘導人多能干細胞(IPS)分化成為功能成熟的胰島β細胞,誘導出的 β 細胞在輸入體內后,具有正常的胰島分泌功能,可以有效恢復糖尿病患者胰島素水平低下的問題,進而維持血糖濃度穩定。

IPS 是具有多項分化潛能的干細胞,可以在體外通過誘導分化成為功能成熟的胰島細胞,但分化效率低下一直是阻礙其發展的重要瓶頸。
鄧宏魁研究團隊大幅度優化了 IPS 向胰島細胞的分化方案,重點解決了如何高效誘導從胰腺前體細胞向胰島內分泌細胞命運特化的技術難題,從而使體外大規模制備功能成熟的胰島細胞成為可能。
在這項研究中,研究團隊將人多能干細胞來源胰島(hPSC-islets)輸注到患有糖尿病的非人類靈長類動物中,發現有效恢復內源性胰島素分泌并改善血糖控制。
所有受試者的禁食和餐前平均血糖水平均顯著下降。同時,病理學檢測結果顯示移植的胰島細胞存活并保持良好的功能。更為重要的是,研究團隊在靈長類動物實驗周期內,未發現移植細胞發生致瘤現象,初步驗證了 hPSC 來源的胰島移植治療方案的安全性。
作為國際首個在非人靈長類模型上系統評價人多能干細胞來源的胰島細胞治療糖尿病可行性的研究。研究結果表明證明了人多能干細胞分化的胰島細胞在糖尿病治療中的安全性和有效性,為 hPSC 胰島在糖尿病治療的臨床研究中提供了理論基礎和數據支撐,發掘了干細胞進一步應用于臨床的巨大潛力,標志著 hPSC 胰島的臨床轉化邁出了實質性的一步。
成果二:證實間充質干細胞治療 2 型糖尿病安全有效
2022 年 5 月,中國人民解放軍第一醫學中心內分泌科母義明教授、生物治療中心韓衛東教授等人在 Stem Cell Reserch& Therapy 期刊上發表了《臍帶間充質干細胞治療中國成人Ⅱ型糖尿病的療效和安全性的2期臨床試驗》,考察了臍帶來源間充質干細胞(UC-MSCs)治療型糖尿病的療效和安全性。
研究結果表明:間充質干細胞治療可能是成人 2 型糖尿病(T2DM)潛在的治療方法。

共有 91 例 2 型糖尿病患者參加了這項臨床試驗,并隨機分為間充質干細胞治療組(45例)和安慰劑組(46例)。UC-MSCs 組給予靜脈輸注 1×10?/kg,共輸注 3 次,每次間隔 4 周。對照組給予安慰劑輸注。
隨訪 48 周結果顯示,13.5% 的患者接受 UC-MSCs 移植 8-24 周后不再使用胰島素,并在 37.2±15.2 周內未再次使用胰島素,而安慰劑組無患者停用胰島素。試驗期間,未發生與 UC-MSCs 移植相關的主要不良事件。
UC-MSCs 的移植可能是Ⅱ型糖尿病的一種潛在治療方法。
成果三:證實間充質干細胞治療保護 1 型糖尿病患的胰島 β 細胞功能
2021 年,南京市鼓樓醫院內分泌科朱大龍教授團隊,在 Stem Cell Research & Therapy 發表了《臍帶間充質干細胞在1型糖尿病重復移植:一項開放、非隨機、平行對照臨床試驗》。

共有 53 例(成人 33 例,青少年 20 例)1 型糖尿病患者參與該研究。MSCs 組 27 例接受治療,對照組 26 例。MSCs 組劑量,1×10?/kg,靜脈輸注 2 次,間隔 3 個月。
隨訪 1 年結果顯示 11 名 MSCs 受試者組達到臨床緩解,顯著高于對照組。其中 3 名 MSCs 治療的成年人實現不依賴胰島素,并在 3-12 個月內保持不使用胰島素,而對照組沒有。
研究提示,對于新發 T1DM 患者,重復 1 次注射 MSCs 是安全的,可能有利于保護胰島 β 細胞的功能。
成果四:間充質干細胞治療 2 型糖尿病的安全性和有效性
發表在《Diabetes, Metabolic Syndrome and obesity》上的一篇綜述闡述了間充質干細胞治療 2 型糖尿病的安全性和有效性。
這篇綜述收集了 6 項臨床試驗,包括 262 名 2 型糖尿病患者,取得了完整結果證實了使用間充質干細胞后可以減少 3-6 個月的胰島素依賴性,降低三個月隨訪期內糖化血紅蛋白 (HbAc1) 水平。

糖尿病的功能性治愈,一直是再生醫學領域的難題。干細胞移植是治療糖尿病最有前景的方法之一,糖尿病患者接受間充質干細胞治療后有望“擺脫”胰島素和口服降糖藥,實現真正意義上的“治愈”。
目前有關干細胞在治療糖尿病并發癥的基礎及臨床使用方面已經取得不少成就,且未觀察到嚴重臨床不良反應。相信隨著研究的不斷深入,應用間充質干細胞來治療糖尿病潛在的并發癥將造福無數糖尿病患者。
免責聲明:我們尊重原創,也注重分享。圖文來源網絡,版權歸原作者所有,如涉及作品內容、版權或其它問題,請聯系我們刪除!


 閩公網安備 35020602002648 號
閩公網安備 35020602002648 號 QQ 客服
QQ 客服
