1型糖尿病,舊稱胰島素依賴型糖尿病,是一種代謝紊亂綜合征,其特征是由于胰島素絕對缺乏引起的高血糖。這種疾病主要是由于通過免疫介導胰腺β細胞的破壞而導致。在一些患者中,可能沒有胰腺β細胞自身免疫性破壞的證據;這被稱為特發性 1 型糖尿病。糖尿病會導致嚴重的慢性并發癥,對患者造成不可逆的多器官損害。這些并發癥包括糖尿病腎病、神經病、視網膜病和心血管疾病。
基于細胞的治療可以通過提供更好的血糖控制來改善糖尿病并發癥。T1D的不同細胞治療策略包括細胞替代、細胞再生和細胞重編程。已經過細胞治療測試的各種干細胞包括造血干細胞 (HSC)、誘導多能干細胞 (iPSC) 和間充質干細胞 (MSC)。
迄今為止,MSCs是臨床試驗中研究主要的細胞群。MSCs的治療能力基于其易于分離、分化成多種細胞類型的能力、低免疫原性、豐富的來源、最小的倫理問題,以及最值得注意的是,它們釋放的生物因子可以緩解受損組織。多項臨床前和臨床研究的結果表明,MSCs應對1型糖尿病有著巨大的治療潛力。其中最常用的是骨髓 (BM) 和臍帶 (UC) 組織。
在一項隨機對照試驗 (RCT) 中,單次移植自體 BM-MSC 在1年的隨訪中顯示出明顯但有限的β細胞功能改善,其中C肽峰值水平增加了約 5%。與單獨接受胰島素的接受者相比,MSC接受者減少了約 5%。沒有觀察到血糖控制或胰島素劑量的改善。在另一項RCT中,接受同種異體 UC-MSC 移植的患者的空腹 C 肽 (FCP) 水平顯著增加(1 年隨訪時增加約 50%),即使在移植后 2年也能改善血糖控制并減少胰島素劑量。盡管兩個 RCT 的治療方案不同,但一個明顯的區別是 MSCs 的組織來源。
薈萃分析的結果表明,UC-MSCs 比 BM-MSCs 對 T1D 有更有益的影響。但由于每種MSC只納入了一項 RCT,UC-MSCs 的優越性需要進一步驗證。
MSCs 的異質性導致治療益處的變化,因此近年來引起了越來越多的關注。組織的起源是第一個確定 MSCs 功能異質性的決定因素。來自不同組織的 MSC 在其增殖能力、血管生成潛力和免疫抑制能力方面各不相同。然而,很少有體內研究系統地比較了 MSCs 對特定疾病的治療效果。目前,各種來源的 MSCs 用于臨床試驗,其中 BM-MSCs 和 UC-MSCs 是最常用的類型。確定這兩種類型的 MSC 在治療 T1D 方面是否存在差異將為臨床轉化提供重要證據。
近日,南京大學醫學院附屬鼓樓醫院內分泌科的研究人員,比較了UC-MSCs 和 BM-MSCs 在 T1D 小鼠模型中的治療效果和機制。隨后又對2009年3月至 2012年7月接受UC-MSC或BM-MSC移植的T1D患者進行回顧性分析,進一步比較其安全性和有效性。

小鼠模型
在小鼠模型中,注射了鏈脲佐菌素。然后小鼠并用骨髓間充質與臍帶間充質作為對照進行靜脈內治療,測量血糖和血清胰島素。治療后兩周,收集胰腺組織以評估胰島炎和β細胞團。進行流式細胞術以評估小鼠脾臟和胰腺淋巴結中T淋巴細胞的組成。
MSC降低小鼠血糖水平
與對照組小鼠相比,BM-MSC組和UC-MSC組在輸注后4、7、11、14天血糖水平明顯低于對照組。然而,沒有觀察到兩種類型的MSC之間的血糖的顯著差異。
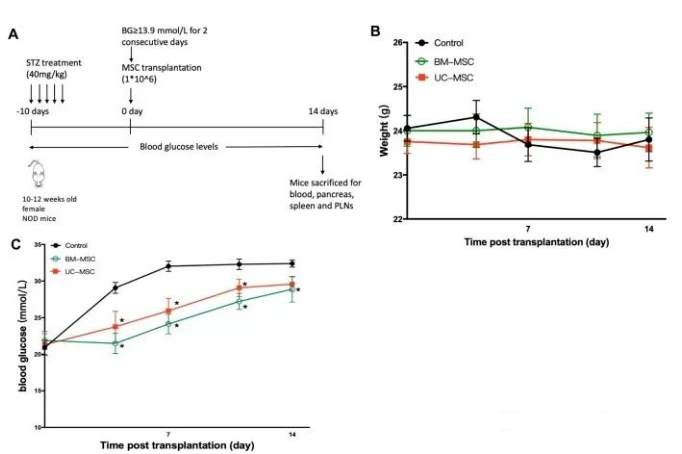
兩者對小鼠體重和血糖的影響
MSC在小鼠中保持β細胞功能
為了研究 BM-MSC 和 UC-MSC 輸注對 β 細胞功能的影響,在 MSC 移植后 14 天對胰島進行免疫組織化學分析,并測量血清胰島素水平。BM-MSC組和UC-MSC組的胰島素陽性區域百分比顯著高于對照組。三組治療后血清胰島素水平均有下降趨勢。在輸血后7天和14天,BM-MSC組和UC-MSC組的血清胰島素絕對水平略高于對照組,但差異不顯著。
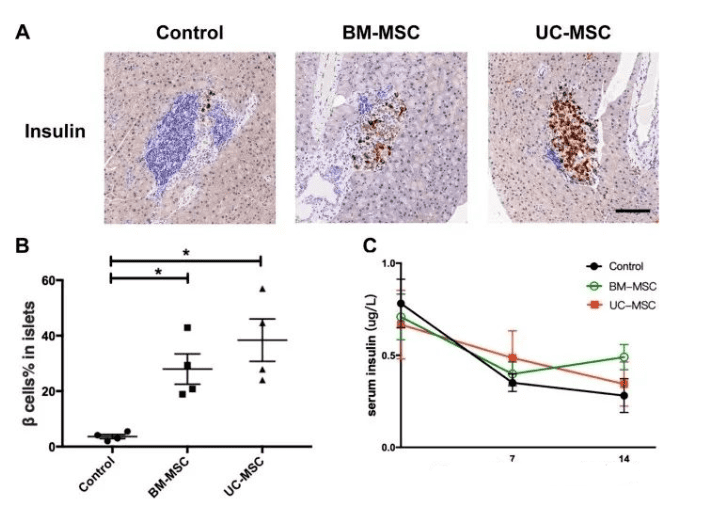
兩者對β細胞質量和胰島素產生的影響
MSC對小鼠的免疫調節作用
T1D 是由免疫細胞(主要是自身反應性 T 細胞)浸潤到胰島和自身免疫介導的β細胞破壞而引起的。在對照組小鼠中,只有 8.7% 的沒有發生胰島炎,超過 50% 的胰島表現出嚴重的胰島炎(> 50% 浸潤)或白細胞完全浸潤。BM-MSC組的胰島炎評分略低于UC-MSC組(1.0±0.1vs1.4±0.2,P>0.05)。然而,在上述兩組之間的比較中沒有觀察到顯著差異,表明BM-MSCs和UC-MSCs具有相當的減少NOD小鼠胰島炎的能力。
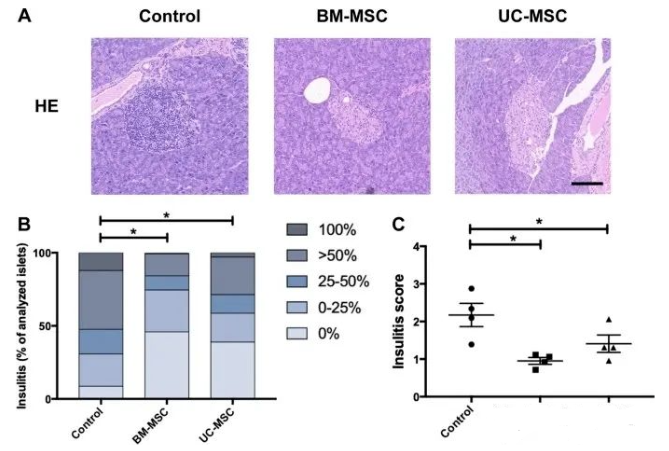
BM-MSCs或UC-MSCs輸注對NOD小鼠胰島炎的影響
小鼠模型研究總結:在NOD小鼠中,UC-MSC和BM-MSC移植在降低血糖水平和保護β細胞方面表現出相似的效果。檢查胰島自身免疫的調節,UC-MSCs和BM-MSCs在胰島炎減弱、T輔助17細胞減少或調節性T細胞增加方面未觀察到顯著差異。
人體研究
2009年3月至2012年7月南京鼓樓醫院共接受MSC移植14例T1D患者;4名患者接受BM-MSC輸血,10名患者接受UC-MSC輸血。此外,14名單獨接受常規胰島素治療的患者作為對照組。所有參與者的平均年齡為18.3±9.3歲,從診斷出T1D到參加本研究的時間范圍為0至12個月。在1年的隨訪期間,任何參與者均未觀察到不良事件。
1年隨訪結束時,MSC治療組4例受者維持臨床緩解(4/14,28.6%),而對照組無1例獲得臨床緩解(P=0.098)。MSC治療組的HbA1c水平顯著降低,而對照組則略有增加(P=0.040)。此外,MSC治療組的每日胰島素劑量顯著低于對照組(P=0.027)。
在1年的隨訪期間,對照組所有患者的C肽水平均下降,而MSC治療組中的4名患者FCP或PCP水平升高。移植后1年的FCP平均水平在對照組中下降了基線水平的61.2%,而接受MSCs治療的患者的基線水平僅下降了36.1%。
此外,PCP的平均水平在對照組中下降了50.4%,在MSC治療組中下降了40.4%。盡管與對照組相比,MSC治療組的FCP和PCP水平降低,但未觀察到顯著差異。
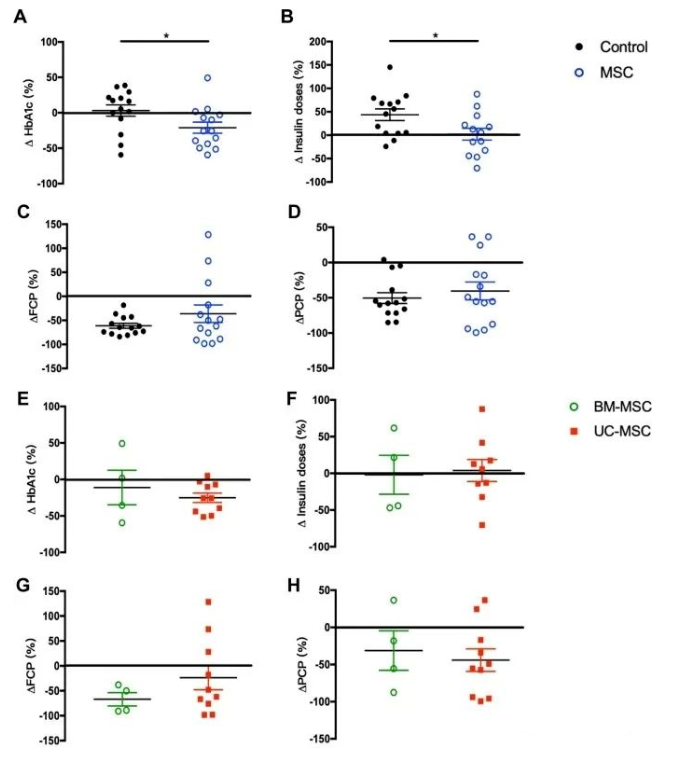
1年隨訪時T1D患者HbA1c、外源性胰島素劑量和C肽的變化
臨床人體研究總結:在T1D患者中,與常規胰島素治療相比,MSC移植顯著降低了血紅蛋白A1c (HbA1c) 水平并減少了胰島素劑量。然而,UC-MSCs和BM-MSCs的治療效果相當,并且它們對患者的內源性β細胞功能也有相似的影響。
相關結論
本研究評估并直接比較了UC-MSCs和BM-MSCs在NOD小鼠和T1D患者中的治療潛力。來自兩種組織來源的MSC顯著改善了血糖控制,并可能有助于保持β細胞功能。此外,UC-MSCs治療T1D的療效不遜于BM-MSCs。
臍帶間充質干細胞和骨髓間充質干細胞在改善1型糖尿病血糖控制和保持β細胞功能方面表現出相當的治療效果。考慮到它們的豐富性和更高的細胞產量,臍帶間充質干細胞在臨床應用中似乎比骨髓間充質干細胞更有希望。
免責聲明:
我們尊重原創,也注重分享。圖文來源網絡,版權歸原作者所有,如涉及作品內容、版權或其它問題,請聯系我們刪除!


 閩公網安備 35020602002648 號
閩公網安備 35020602002648 號 QQ 客服
QQ 客服
