目前,免疫療法可以通過重新刺激 T 細胞的活性并增強其抗腫瘤作用來治療癌癥。這種療法幫助特定類型腫瘤的患者延長了生存期,但由于免疫療法對 T 細胞的持續刺激,T 細胞逐漸發展為功能衰竭,限制了其進一步的抗腫瘤作用。這是免疫療法目前面臨的一大挑戰。
當 T 細胞衰竭發生時,多能前體 T 細胞逐漸轉化為終末分化的 T 細胞,而后者對免疫檢查點抑制劑沒有反應,這也是免疫療法逐漸產生耐藥性的原因。科學家們正試圖破譯 T 細胞衰竭的分子機制,并進行干預,使免疫療法更有效、更持久。
近日,美國圣裘德兒童研究醫院的一個研究小組在 Science 雜志上發表了一項重要研究成果,揭示敲除 ASXL1 基因可以顯著增強 T 細胞的抗腫瘤作用,為開發更有效的 T 細胞免疫療法提供了新思路。

長期 T 細胞刺激可導致功能衰竭,這是限制基于 T 細胞的免疫治療持續性的主要因素之一。在抗腫瘤過程中,T 細胞逐漸從多能前體狀態(Tpex)轉變為終末分化狀態(Tex),處于 Tex 狀態的 T 細胞對免疫檢查點阻斷(ICB)治療沒有反應。研究人員意外發現,一組骨髓增生異常綜合征(MDS)患者在接受抗 PD-L1 治療后,生存期顯著延長。進一步的研究發現,ASXL1 基因在這些患者的 T 細胞中發生了突變。
ASXL1 基因與另外兩個基因(DNMT3A 和 TET2)一樣,是克隆性造血(CH)的調節因子,與造血干細胞存活優勢的增加有關。研究人員推測,這些基因的變化可能會影響 T 細胞的分化過程,從而影響抗 PD-L1 治療的有效性。
為了驗證這一假設,研究人員使用 CRISPR 技術敲除小鼠 T 細胞中的 DNMT3A、TET2 和 ASXL1 基因,并將這些修飾的 T 細胞植入小鼠體內,使其暴露在持續的病毒感染環境中。實驗結果表明,當這些特定基因被敲除時,T 細胞會持續受到刺激并分裂長達一年,但它們沒有表現出任何功能異常,而是表現出干細胞樣狀態特征。
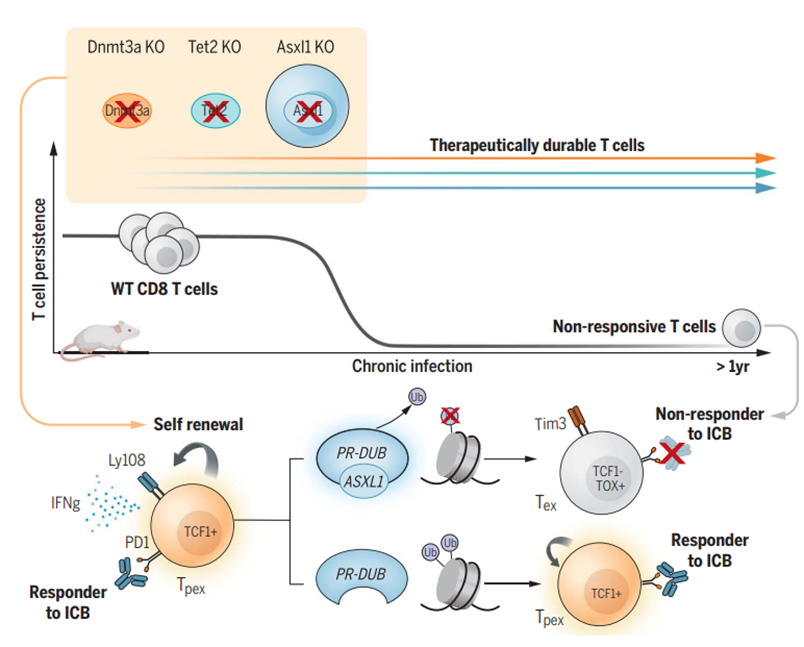
在研究中,ASXL1 基因的作用尤為突出。敲除 ASXL1 基因不僅可以使 T 細胞更活躍地增殖,還可以保持更高的干細胞特性。這些細胞在面對抗原時仍然可以表現出強大的效應器功能,并且可以在更長的抗原刺激時間內保持干性而不會發生惡性增殖。
在感染淋巴細胞性脈絡叢腦膜炎病毒(LCMV)的小鼠模型中,作者將這些修飾的T細胞引入小鼠體內,使其受到長期抗原刺激。在 LCMV 感染 30 天后,作者仍然能夠在小鼠脾臟中獲得大量具有干燥特征的 ASXL1 KO T 細胞,這些細胞在面對抗原時表現出很強的效應功能。在較長的抗原刺激時間內,這些 T 細胞可以保持干燥而不會惡性增殖。
隨后,研究人員構建了一批黑色素瘤和癌癥小鼠模型,這些模型通常具有較強的免疫抑制作用。他們還將 ASXL1 基因敲除T細胞注射到小鼠體內,隨后對一些小鼠進行抗 PD-L1 治療。首先,單獨獲得 ASXL1 KO T 細胞足以幫助小鼠進行抗腫瘤治療并延長存活時間。在添加抗 PD-L1 治療后,可以進一步控制腫瘤的發展。與僅含有野生型 T 細胞的小鼠相比,含有 ASXL1 KO T 細胞的腫瘤小鼠對免疫療法的反應更持久。作者發現,ASXL1 KO T 細胞在一年后仍然可以在小鼠體內維持一小部分,避免 T 細胞衰竭,并且仍然具有抗腫瘤特性。
該研究的共同通訊作者 Ben Youngblood 博士指出:“ASXL1 就像一個調節T細胞末端分化的表觀遺傳檢查點,新的研究結果有望幫助我們開發和設計更耐用的抗腫瘤 T 細胞。”
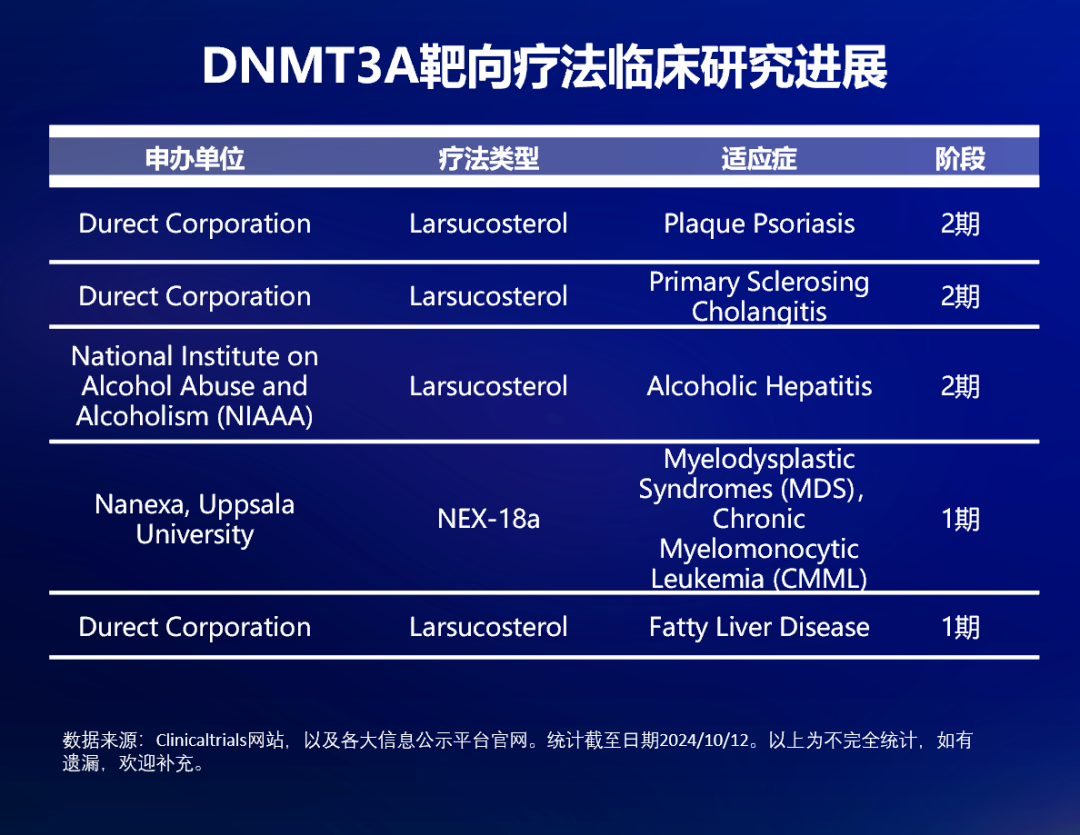
值得一提的是,新的研究還發現,在沒有 DNMT3A 和 TET2 的情況下,T 細胞可以獲得更強的增殖能力,并對抗 PD-L1 治療產生有效反應。目前,ASXL1 和 TET2 的靶向研究處于臨床前階段,而 DNMT3A 的靶向性研究取得了一些臨床進展。
免責聲明:我們尊重原創,也注重分享。圖文來源網絡,版權歸原作者所有,如涉及作品內容、版權或其它問題,請聯系我們刪除!


 閩公網安備 35020602002648 號
閩公網安備 35020602002648 號 QQ 客服
QQ 客服
