國家藥監局評審中心日前就《中國食品藥品監管》發文,對我國先進治療藥物的范圍和分類進行了探索。細胞產品有望躋身先進治療藥物行列!

以細胞和基因治療產品為代表的先進治療醫療產品(ATMP),為癌癥、遺傳病、罕見病等疑難疾病的治療帶來了新的機遇和選擇。
根據 Citeline 數據庫統計,截至 2024 年 4 月,已有 100 多種基因、細胞和 RNA 產品獲準在全球上市,3700 多種產品(包括約 55% 的基因治療產品和 53% 的細胞治療產品)處于臨床前或臨床(約 30%)開發階段。
盡管中國的先進治療行業起步較晚,但目前已發展成為全球細胞治療研發熱情最高的地區。根據臨床試驗的不完全統計。根據政府網站,中國用于細胞治療的臨床試驗和申報產品數量位居世界第二,僅次于美國。
自 2021 年中國首個嵌合抗原受體 T 細胞(CAR-T)治療藥物獲批以來,中國推出的 CAR-T 產品數量已占全球同類產品的 50% 以上。我國先進加工業發展已進入與國際先進水平并駕齊驅的新階段。
全球許多國家和地區不斷致力于加強 ATMP 監管體系的頂層設計和監管能力建設。美國食品藥品監督管理局(FDA)、歐洲藥品管理局(EMA)、日本藥品醫療器械綜合機構(PMDA)等藥品監管機構逐步建立了 ATMP 的監管框架,積極制定和發布相關法規和指南,并不斷完善。據不完全統計,到目前為止,全球監管機構已經發布了 400 多項與細胞和基因治療產品相關的技術指南。一些國家和地區在法律和監管層面明確了此類藥物的定義和分類,并制定了激勵政策(如特殊審評程序等),以加快產品審批和上市。
中國國家醫療產品管理局(NMPA)目前已發布了 30 多項與該類產品相關的技術指導原則,涵蓋研發、注冊、工業化生產和上市后變化等各個階段。在中國,這類產品適用于鼓勵創新和加快審批等各種程序。然而,這類藥物的分類和定義尚未在法律和監管層面得到明確界定。名稱和分類尚未形成行業共識,名稱的使用和分類不一致,不利于規范監管、行業溝通和國際協調。
作者認為,分類與產業發展密切相關,明確 ATMP 在中國的分類和定義迫在眉睫。
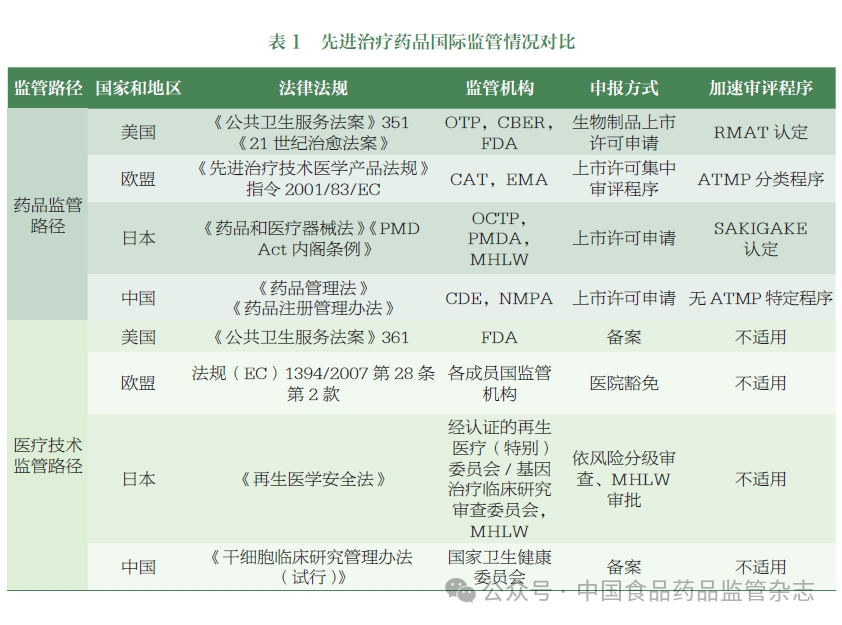
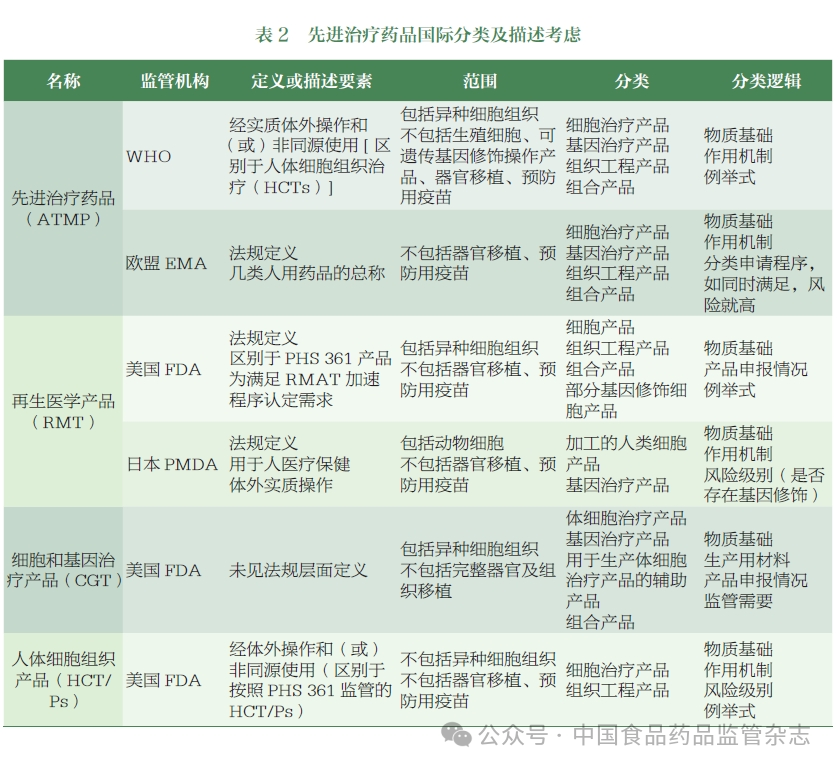 基于國外監管機構對 ATMP 監管分類的研究,CDE 組織相關部門梳理了國內相關產品的應用情況,初步提出了 ATMP 在中國的分類和描述,并舉行了專家研討會,邀請了學術界、行業和監管領域的專家,就名稱制定、分類和描述的關鍵考慮進行了討論,形成了以下建議。
基于國外監管機構對 ATMP 監管分類的研究,CDE 組織相關部門梳理了國內相關產品的應用情況,初步提出了 ATMP 在中國的分類和描述,并舉行了專家研討會,邀請了學術界、行業和監管領域的專家,就名稱制定、分類和描述的關鍵考慮進行了討論,形成了以下建議。
名稱和描述
參照 FDA、EMA、PMDA及 WHO 等監管機構的命名,結合現階段國內行業使用的術語,該類產品的名稱應主要考慮符合國際標準,同時體現產品的創新性和技術先進性,以鼓勵我國相關行業的發展,并具有前瞻性,為未來新興技術藥物預留監管空間。可參考世界衛生組織和歐洲藥品管理局考慮通用名稱和具體分類,確保通用名稱突出藥品屬性,涵蓋大部分相關藥品類別,同時做好分類歸屬細化工作。考慮到“細胞和基因治療產品”主要反映產品的物質基礎,“再生醫學產品”主要體現產品功能,相對有限。“先進治療藥物”的覆蓋范圍相對較廣,并與世界衛生組織等國際監管機構協調。建議使用“先進治療藥品”作為此類產品的中文名稱,英文名稱為“ATMP”。
基于國際監管機構對此類產品的定義和專家意見,作者認為,“先進治療藥品”的描述應考慮物質基礎、工藝特點、功能用途等內容。同時,應根據體外操作的程度和使用情況來定義醫療技術相關邊界產品的分類。考慮到該類產品受藥品監管,作者將以“體外操作”和“功能性使用”作為ATMP的描述元素,并基于我國相關產品申報的現狀和未來發展趨勢,基于活性成分的多樣性和創新性,完善相關描述。它被描述為:“先進的治療藥物是指通過體外操作生產并在體內發揮作用的細胞治療藥物、基因治療藥物或組織工程藥物,以及使用其他先進技術/方法生產的創新藥物。”ATMP 的生產和研究過程必須符合中國的倫理要求。用于輸血的血液成分和用于移植的造血干細胞不在 ATMP 范圍內。
在物質基礎上,可以考慮包括在中國有大量應用的產品,如細胞治療產品和基因治療產品,以及組織工程產品和其他新興技術產品,為新技術預留接口。從工藝特征上看,結合 FDA、EMA、WHO 等相關定義,通過簡單的體外操作制備并同源使用的細胞組織治療產品不屬于 ATMP。因此,基于國際監管實踐和產品生產中常見的工藝步驟,作者在說明書中對“體外操作”進行了簡單的定義,主要包括分離、純化、擴增、基因修飾、基因編輯等。未來如有必要,我們將參考美國食品藥品監督管理局等監管機構的做法,進一步明確“體外操作“和“同源使用”的定義。在功能用途方面,參考目前國內生物制品的監管現狀,考慮到目前申報的產品主要是治療性生物制品,說明書僅明確說明為治療性藥物,目前不涉及預防或診斷目的。
基于專家建議,作者進一步對涉及生殖細胞使用的醫療技術和產品等邊界產品進行了分類和界定。在醫療技術方面,說明書明確排除了輸血、器官/組織移植等屬于國家衛生健康委員會管理的醫療技術。需要注意的是,這里的移植指的是醫療機構使用的治療方法,而不是給藥途徑。例如,用于移植和給藥的轉基因造血干細胞由于其在體外的復雜生產操作而屬于 ATMP 的類別。對于涉及使用生殖細胞和一些可遺傳基因改造操作的產品,由于來源和操作多種多樣,說明書明確指出需要滿足中國的倫理要求。
分類建議
為了增強監管的科學性和有效性,鼓勵藥物研發的持續創新,結合國際分類、產品物質基礎、監管風險水平和國內產品研發申報情況,作者對ATMP分類進行了初步研究,并探討了分類和相關產品歸屬的合理性。
ATMP 是目前生物醫藥領域最有前景和前景的發展方向,在國際競爭和國家戰略規劃中占有重要地位。臨床價值引領、全產業鏈政策支持、前沿技術創新驅動、持續資金支持、科學嚴格監管護航,將共同推動我國先進治療產業高質量發展,培育生物制藥新的質量生產力,及時滿足人民群眾未滿足的臨床需求。
當前,生物制藥行業整體面臨資金寒冬,產品管線推進受阻。目前,市場上的產品數量有限,而且價格很高。醫療保險尚未完全覆蓋,市場支付能力不足。在藥物供應、可及性和可負擔性方面仍然存在巨大差距。
因此,監管機構應更多地關注和支持此類產品的研發,并提供更明確的監管政策和激勵措施。
本文提供的 ATMP 分類和定義建議使總體分類框架和邏輯與主要國際監管機構的分類系統保持一致。有望為未來監管分類相關配套政策的制定提供參考,并指導相應技術指南、標準體系的完善和國際監管協調,從而進一步提高 ATMP 的監管效率,加快相關產品的研發申請、審批和上市,幫助滿足人民群眾未滿足的臨床需求。
免責聲明:我們尊重原創,也注重分享。圖文來源網絡,版權歸原作者所有,如涉及作品內容、版權或其它問題,請聯系我們刪除!


 閩公網安備 35020602002648 號
閩公網安備 35020602002648 號 QQ 客服
QQ 客服
