近年來,細胞和基因治療顯示出巨大的輝煌,在不久的將來,批準的細胞和基因療法產品數量將急劇增加。2019 年初,美國食品藥品監督管理局宣布了未來細胞治療的發展計劃。預計到 2025 年,該領域每年將有 10-20 種新藥獲批,包括細胞和基因治療產品。近日,據外媒報道,預計到 2023 年底,美國、歐洲或兩者將批準 13 種新的細胞或基因療法。

隨著 CRISPR 等基因組編輯技術的出現和人們對免疫學認識的加深,以及特殊生物樣品和材料的培養、制造、運輸、儲存和加工的優化,細胞治療領域正在發生革命性的變化。
目前,CAR-T 等免疫細胞療法為一些腫瘤的治療帶來了新的選擇。然而,細胞技術的發展和不同干細胞的應用,如脂肪干細胞、間充質干細胞和誘導多能干細胞,將為神經系統、肌肉骨骼和皮膚病等腫瘤以外的疾病提供更好的選擇。
細胞療法的獨特應用和治療優勢
細胞療法是一種以細胞為基礎,以活細胞為活性藥物治療疾病的治療方法。細胞療法是目前臨床上最有前途的治療方法,有可能治愈多種難治性疾病。與其他療法相比,細胞療法具有獨特的臨床應用和治療優勢。
首先,活細胞可以動態消除惡性腫瘤,再生組織細胞,恢復受損的組織功能,并根據自身情況增加身體抵抗疾病的能力。
其次,活細胞可以對系統和局部的化學、物理和生物變化做出反應。
此外,活細胞更容易突破生物屏障,實現精確的分子靶向功能,準確定位細胞和組織,并與其相互作用以實現治療功能。
全球細胞療法的發展概況
目前,全球細胞治療市場主要由干細胞、組織特異性細胞和血細胞組成。
干細胞療法
目前,批準用于臨床的干細胞療法包括造血干細胞(HSCs)、間充質干細胞(MSC)和角膜緣干細胞(LSCs)。造血干細胞(HSC)產品主要被批準用于治療血液疾病。間充質干細胞(MSCs)治療適用于多種疾病,包括心血管疾病、移植物抗宿主病(GvHD)、退行性疾病、炎癥性腸病和其他難治性疾病。角膜緣干細胞(LSC)產品僅被批準用于角膜緣干細胞缺陷。

▲ 全球獲批上市的近 20 款干細胞產品
組織特異性細胞療法
組織特異性細胞主要用于再生醫學和組織工程,如用于治療熱燒傷的自體皮膚細胞(即角質形成細胞、成纖維細胞和黑素細胞),用于治療糖尿病下肢靜脈潰瘍和足潰瘍的雙層活細胞皮膚替代物,以及用于修復軟骨缺損的自體軟骨細胞支架。
血細胞療法
包括白細胞、紅細胞和血小板。然而,目前只有 T 細胞和 DC 細胞被批準用于臨床治療。大多數 T 細胞產物是嵌合抗原受體(CAR-T)治療惡性血液病,而 DC 細胞治療被用作癌癥疫苗。
根據近年來全球細胞治療臨床研究綜述,五年前針對間充質干細胞的臨床試驗和研究數量排名第一。近年來,對單個 T 細胞進行測試的研究數量遠遠超過了對所有干細胞和組織特異性細胞的研究數量。這一重大轉變主要是由于 CAR-T 療法的成功臨床應用(見下圖)。從統計數據來看,T 細胞主導了當前細胞治療的臨床研究,其次是干細胞、樹突狀細胞、自然殺傷細胞、微生物、紅細胞、單核細胞和血小板。
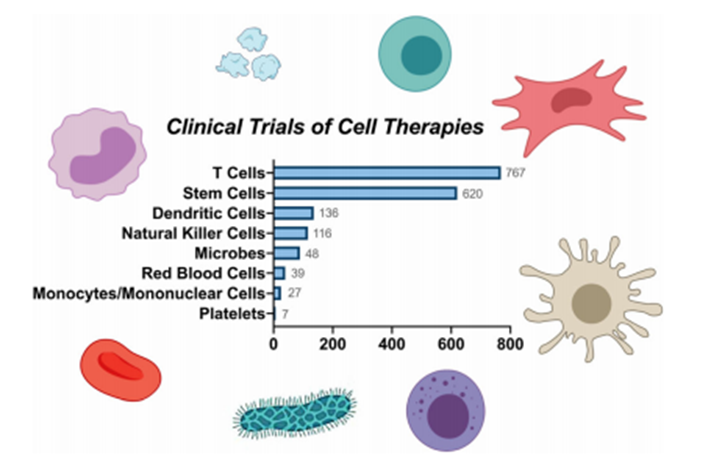
▲ 臨床試驗中的各種類型的細胞療法
全球 T 免疫細胞治療的發展概況
截至目前,全球市場上共有 7 種 CAR-T 免疫細胞治療產品。
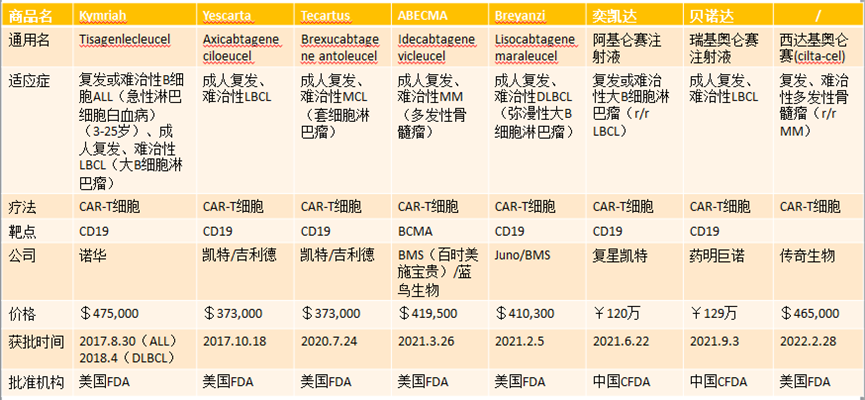 此外,其他 T 細胞療法已被用于治療實體瘤。
此外,其他 T 細胞療法已被用于治療實體瘤。
ImmunCell-LC 于 2007 年獲得 KFDA 批準,是一種基于自體細胞因子誘導殺傷(CIK)細胞的免疫療法。主要用于腫瘤切除后的輔助治療。它可以通過去除殘留的腫瘤細胞來治療肝細胞癌、腦腫瘤和胰腺癌癥。
目前,T 淋巴細胞治療的臨床試驗如下圖所示。T 淋巴細胞是所有細胞治療試驗中研究最多的細胞類型,占所有試驗的 45%。根據它們的狀態,它們被分為轉基因(GM)和非轉基因(NGM)。轉基因(GM)細胞根據其受體類型分為嵌合抗原受體(CAR)和 T 細胞受體(TCR),而非轉基因(NGM)細胞則根據其靶標類型分為靶向腫瘤相關抗原(TAA)和病毒抗原(VST)。如果沒有明確的受體或靶標,則將其歸類為“其他”。
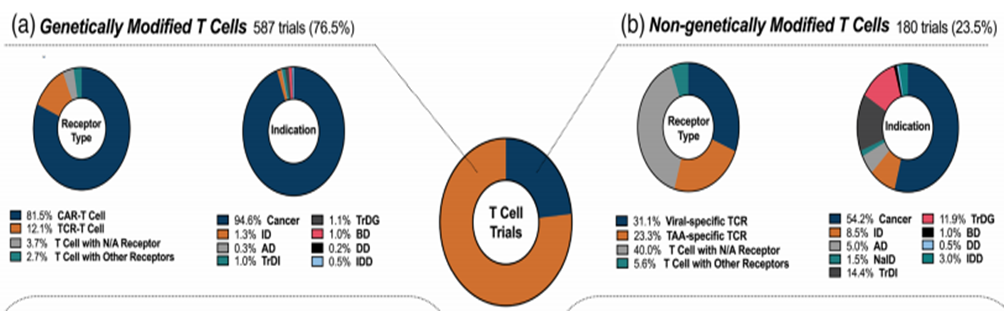
▲ T 細胞臨床試驗的現狀
如圖所示,在目前針對 T 細胞的臨床試驗中,轉基因(GM)T 細胞占 76.5%,而非轉基因(NGM)T 細胞約占 23.5%。轉基因類別試驗根據轉基因受體的類型進一步分類。其中,靶向 CAR-T 細胞治療的臨床試驗占轉基因(GM)T 細胞的 81.5%,TCR-T 細胞的 12.1%,具有不適當受體(N/A)的 T 細胞的 3.7%,其他 T 細胞受體的 2.7%,TAA 特異性 T 淋巴細胞的 23.3%,具有不當受體(N/A)的 T 細胞的 40.0%,以及其他 T 細胞靶點的 5.6%。
CAR-T 細胞治療
目前,絕大多數已批準的 CAR-T 療法都專注于 CD19 靶點。此外,BCMA、CD22 和 CD20 也已成為流行的靶點。
由于缺乏明確的細胞外抗原靶點、T 細胞浸潤不足以及難以克服免疫抑制的腫瘤微環境,CAR-T 治療在實體瘤中仍然是一個巨大的挑戰。目前,約 24% 的臨床試驗靶點仍用于實體瘤。最常見的靶點是 GD2(神經母細胞瘤和黑色素瘤)、HER2(轉移性乳腺癌)和 GPC3(癌癥)。
除了研究不同的腫瘤細胞外抗原靶點外,CAR-T 細胞治療的不同給藥方法也是研究熱點。目前,CAR-T 治療的主要給藥途徑仍然是靜脈給藥,而其他給藥途徑也在研究中,如腹膜內、腫瘤內、肝內動脈、胰腺內和胸膜內給藥。不同的給藥方法可能在預防 T 細胞衰竭、提高靶點特異性和促進組織浸潤方面具有優勢,這可能會增加 CAR-T 目前在實體瘤治療中的應用。
TCR-T 細胞治療
TCR-T 細胞療法通過與 MHC 的有效相互作用激活宿主的免疫系統。與 CAR-T 細胞療法只能識別腫瘤表面的特異性抗原不同,TCR-T 細胞療法可以識別細胞內的腫瘤特異性抗原,使 TCR-T 細胞療法在腫瘤治療中更有效。NY-ESO-1 是最常見的靶抗原,在許多癌癥中表達,包括骨髓瘤、黑色素瘤等。其他腫瘤相關抗原,如 PRAME 和 MAGE 蛋白,黑色素瘤分化抗原 MART-1 和 gp100,以及最近的癌癥驅動因素,如 WT1、KRAS 和 TP53,也是流行的 TCR-T 靶點。
病毒特異性 T 細胞(VST-T)治療
VST 目前正在進行治療癌癥、移植相關疾病和感染的臨床研究。VST 可以通過識別 MHC 上的病毒表位來消除病毒誘導的癌癥,還可以用于治療與癌癥和/或移植無關的病毒感染,如艾滋病病毒和嚴重急性呼吸綜合征冠狀病毒(SARS 冠狀病毒 2 型)。
TAA 特異性 T 淋巴細胞治療
目前,大約 2/3 的 TAA 特異性 T 淋巴細胞療法被設計用于治療實體瘤,一些試驗目前處于臨床試驗的第二階段。
總之,T 淋巴細胞治療癌癥的臨床試驗目前正在蓬勃發展。T 淋巴細胞療法不同于傳統的治療疾病的方法,是一種有效的治療方法,已被 FDA、EMA 和世界各地的其他監管機構批準用于治療癌癥。
然而,仍然存在重大挑戰,包括生物來源的安全性和免疫原性、生物功能的異質性、細胞治療后生物活性的維持、最佳遞送方法的選擇,以及細胞治療劑的制造和調節方面的挑戰。
隨著臨床研究的進展,基于 T 免疫細胞的治療有望成為治療更多疾病的新選擇。
全球細胞治療監管政策促進發展
從第一次干細胞移植到今天的工程細胞療法獲得批準,花了將近 50 年的時間。隨著研究和調控的逐漸發展和成熟,人們可以看到下一代基于細胞的治療可以在更短的時間內惠及更多患者。目前,世界各地正在采取不同的措施來加快創新新藥的審批。
例如,美國食品藥品監督管理局有幾種加快審批的方法,如再生醫學高級治療資格認證(RMAT)、快速通道資格認證等。美國食品藥品監管局表示,未來將加強與產品開發商的溝通與合作,以最大限度地利用這些渠道。
在中國,自 2018 年 11 月以來,中國新藥臨床試驗正式從以前的審批制度轉向默示許可,從“點頭制”審批轉向“搖頭制”審批時代,這意味著中國新藥臨床實驗行政許可將進入更高效的審查模式。
在過去幾年中,美國、澳大利亞、歐盟、日本、韓國、中國和其他地區已經批準推出新的細胞治療產品,包括免疫細胞治療產品和干細胞治療產品。未來,隨著監管、審批和支付方式的逐步完善,這類產品的發布速度將更快,市場滲透率將更大。這意味著更多的患者將能夠使用細胞治療產品。
免責聲明:
我們尊重原創,也注重分享。圖文來源網絡,版權歸原作者所有,如涉及作品內容、版權或其它問題,請聯系我們刪除!


 閩公網安備 35020602002648 號
閩公網安備 35020602002648 號 QQ 客服
QQ 客服
