2024 年 6 月 27 日,中國國家醫藥產品監督管理局藥品審評中心發布了令人振奮的消息:一種干細胞新藥——艾米邁托賽注射液(人臍帶間充質干細胞)被列入優先批準品種名單。
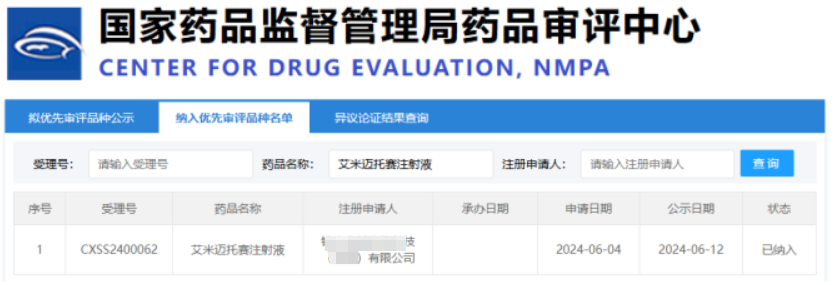
據悉,這是國內首個申請上市的干細胞新藥,臨床適應癥為激素衰竭的急性移植物抗宿主病(aGVHD)。
移植物抗宿主病(GVHD)是一種在骨髓移植(BMT)后引起多系統損傷的系統性疾病,是導致死亡的重要原因之一,分為急性(aG)和慢性(cG)。前者發生在 BMT 后 3 個月內,后者發生在 BMT 后 3 個月中。免疫功能低下的個體在接受不同 HLA 水平的血液時也可能出現 GVHD,這可能是致命的。移植物抗宿主病是一種免疫反應異常的系統性疾病,臨床表現復雜。受影響的主要器官是皮膚、消化道和肝臟。局部使用可的松軟膏對皮膚損傷有效,全身治療包括營養支持、潑尼松、環磷酰胺、抗淋巴細胞球蛋白、環孢菌素、硫唑嘌呤等。食道擴張和抗反流治療可以有效緩解癥狀,但擴張過程中有穿孔的風險。
間充質干細胞具有再生、抗炎和免疫調節特性,這是通過調節先天和適應性免疫反應,抑制T、B 淋巴細胞和 NK 細胞的增殖和功能,以及樹突狀細胞的成熟,并誘導調節性 T 細胞的產生來實現的;其中一些作用是由可溶性因子如轉化生長因子 β(TGF-β)和前列腺素 E2 介導的。由于其免疫抑制特性,間充質干細胞被認為是移植物抗宿主病(GVHD)和預防移植排斥反應的潛在候選者。
01 什么是優先審批?
優先審評審批流程是指符合一定條件的藥品申請優先進入藥品審評中心的審評審批流程,以加快其上市進程。該方案適用于臨床急需的罕見病藥物和兒科藥物等特殊類型的藥物。這些藥物之所以能夠申請優先審評審批程序,是因為它們具有明顯的臨床優勢,可以顯著提高醫療保障水平,提高患者的治療效果和生活質量。
02 如何才能被納入優先審批品種名單?
要被納入優先審批品種名單,藥物需要滿足以下嚴格條件:
臨床急需:對于現有治療方法無效或沒有有效治療方法的嚴重疾病,可以顯著改善患者的健康狀況。
強有力的創新:藥物在治療機制、療效和安全性方面有重大創新,可以填補現有的醫療空白。
充分的臨床試驗證據:該藥物在臨床試驗階段表現出明確的療效和可接受的安全性,具有充分的科學依據。
艾米邁托賽注射液通過利用人臍帶間充質干細胞修復受損組織和調節免疫功能,在治療激素治療失敗的急性移植物抗宿主病(aGVHD)方面顯示出顯著的療效和安全性,這就是它入選優先審批名單的原因。
03 被納入優先審批品種名單意味著什么?
被列入優先審評品種名單的主要目的之一是加快藥品上市進程。當一種藥物被列入優先審評品種名單時,它將獲得在藥品審評審批過程中的優先處理權。這意味著相關部門將優先審查和批準該藥物,以確保其盡快完成相關流程。
審評審批的優先處理,加速上市進程
優先審批機制可以顯著縮短藥物從申請到最終批準的時間。有數據顯示,2020 年 7 月以來,納入優先審批的藥品平均審批時間為 28.2 天,最快僅 2 天,最慢僅 150 天。
目前在國際上,美國、韓國、日本、歐盟等均已有經批準的干細胞治療產品上市。2016 年 2 月,日本間充質干細胞注射 temcell 的價格為每袋 868680 日元(每療程 8 袋,成年患者預計需要 2-3 個療程,費用約為10-15 萬美元)。

政策和技術支持
國家藥品監督管理局會為納入優先審評品種名單的藥品提供更多的技術指導和政策支持。這包括優先安排審評資源、加快審評速度、提供必要的審評支持等。
在細胞治療發展的各個階段,政策的支持、監管和引導均發揮著重要的作用,并推動著細胞療法從無序走向有序并逐漸發展成熟。
資源傾斜
將在這些藥物的評估中投入更多的專家資源和技術專長,以確保其高效、快速地獲得批準。
04 艾米邁托賽注射液上市時間預期
如果一切順利,根據優先批準的平均時間,艾米邁托賽注射液預計將在幾個月內獲得市場批準。對于急需新療法的患者來說,這無疑是一個令人興奮的消息。特別是對于激素治療失敗的急性移植物抗宿主病(aGVHD)患者,他們將能夠在國內獲得這種新的治療選擇。
與這些高昂的國際價格相比,艾米邁托賽注射液的預期價格應該低得多,這將大大減輕患者的經濟負擔,并使更多的患者能夠負擔得起這種創新療法并從中受益。
艾米邁托賽注射液(人臍帶間充質干細胞)成功納入優先審批品種名單,標志著其離正式上市又近了一步。這一消息不僅為醫藥行業注入了新的活力,也給患者帶來了新的希望。我們期待更多像艾米邁托賽這樣的創新藥物在未來盡快問世,為人類健康事業做出更大貢獻。
免責聲明:我們尊重原創,也注重分享。圖文來源網絡,版權歸原作者所有,如涉及作品內容、版權或其它問題,請聯系我們刪除!


 閩公網安備 35020602002648 號
閩公網安備 35020602002648 號 QQ 客服
QQ 客服
